题目内容
【题目】下列说法错误的是( )
A.钠在空气中燃烧最后所得产物为过氧化钠
B.镁在空气中能稳定存在,是因为其表面形成了致密的氧化膜
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.铁不能形成致密的氧化膜,在潮湿的空气中易生锈
【答案】C
【解析】
钠在空气中燃烧生成的产物是过氧化钠;
镁和铝化学性质都很活泼,但二者在空气中表面都能形成一层致密的氧化膜,使内层的金属与空气隔绝,不再被氧化,金属镁或铝制品在空气中都能稳定存在;
铁表面不能形成致密的氧化膜,在潮湿的空气中被氧化而生成疏松的氧化物,内层金属铁不能与空气隔绝,逐渐生锈被腐蚀。
答案选C。

【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=?
2N2(g) +6H2O(g) △H=?
(1)
化学键 | H—O | O===O | N≡N | N—H |
键能kJ·molˉ1 | a | b | c | d |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内n(NO)/n(NH3)=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
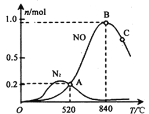
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
②520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=___________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=___________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
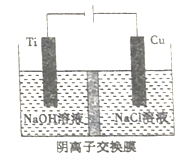
(4)纳米级Cu2O 由于具有优良的催化性能而受到关注,工业上常用电解法Cu2O,其反应为2Cu+H2O![]() Cu2O+H2↑ 采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,则阳极上的电极反应式为___________________,当生成_______克Cu2O时,就会有NA个阴离子通过离子交换膜。
Cu2O+H2↑ 采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,则阳极上的电极反应式为___________________,当生成_______克Cu2O时,就会有NA个阴离子通过离子交换膜。