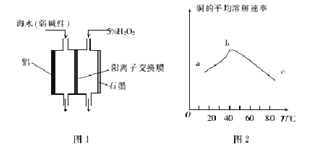
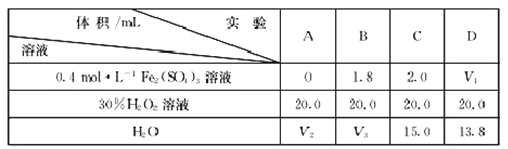
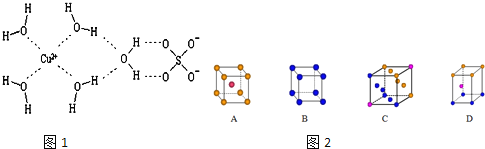
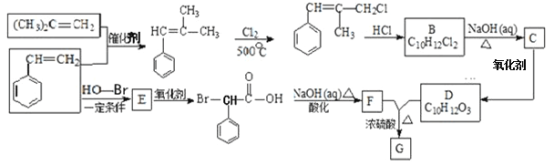
��Ŀ����
����Ŀ����ʽ������(NiOOH)�����������ص��������ϡ��Ժ�����Ni2+����ҺΪԭ������NiOOH��һ��T������������

��1������Na2CO3��Һʱ��ȷ��Ni2+�Ѿ���ȫ������ʵ�鷽���� ��
����ʱ���õ��IJ����������ձ��� ��
��2��д��̼������ϡ���ᷴӦ�����ӷ���ʽ�� ��
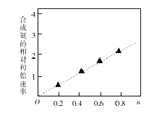
��3����������Һ�������Ʊ��ϳɰ��Ĵ���CoNi(1-n) Fe2O4�� ��ͼ��ʾ������������ͬʱ�ϳɰ�����Գ�ʼ�����������wֵ�仯�����ߣ���ͼ������֪Co2+��Ni2+���������д�Ч�����õ��� ��
��4��д���ڿ����м���Ni(OH)2��ȡNiOOH�Ļ�ѧ����ʽ��__ _��
��5�������Ȳ���֣��Ƶõ�NiOOH�л����Ni(OH)2������ɿɱ�ʾΪxNiOOHyNi(OH)2���ֳ�ȡ9.18g��Ʒ����ϡ���ᣬ����100mL1.0mol/LFe2+����Һ����������Һ���壬������200mL��ȡ��20.00mL����0.010molL��1 ��KMnO4����Һ�ζ�����ȥKMnO4����Һ20.00mL����ͨ������ȷ��x��y= ��[��֪��Ӧ��δ��ƽ����NiOOH+Fe2++H+=Ni2++Fe3++H2O��Ni2+ +MnO4 -+H+![]() Ni3++ Mn2++H2O]
Ni3++ Mn2++H2O]
���𰸡���1�����ã����ϲ���Һ�м����μ�1~2��Na2CO3��Һ���������ɣ�©��������������2�֣�
��2��NiCO3+2H+=Ni2++H2O+CO2����1��������3��Co2+��2������
��4��4Ni(OH)2+O2![]() 4NiOOH+2H2O��2��������5��9��1��2������
4NiOOH+2H2O��2��������5��9��1��2������
��������
�������������(Ni2+)��ҺΪԭ������NiOOH���ں�Ni2+�ķ�Һ���м���̼������Һ�����˵õ�NiCO3�����������м��������ܽ�����NiSO4�������Լ�������Һ��pHʹ������ȫ����������Ni(OH)2���ڿ����м���Ni(OH)2��ȡNiOOH����1��ȷ��Ni2+�Ѿ���ȫ������ʵ�鷽����ȡ�ϲ���Һ������̼������Һ�۲��Ƿ��г������ɣ��ж��������Ƿ�ȫ�������������������Ϊ�����ã����ϲ���Һ�м����μ�1��2��Na2CO3��Һ���������ɣ���֤��������ȫ�������õ��IJ����������ձ���©��������������2��̼������ϡ���ᷴӦ������������������̼��ˮ����Ӧ�����ӷ���ʽΪNiCO3+2H+=Ni2++H2O+CO2������3����ͼ��֪����nֵԽ�ϳɰ�����Գ�ʼ����Խ��n����Co2+�ı�������Co2+�Ĵ����Ը�������4�������м���Ni(OH)2�Ϳ�����������Ӧ����NiOOH��ˮ������ԭ���غ���ƽ����ѧ����ʽΪ��4Ni(OH)2+O2 ![]() 4NiOOH+2H2O����5������KmnO4���ʵ�����0.01 mol/L�� 0.02L =2��10-4mol����NiOOH��Ӧ��ʣ���Fe2+���ʵ�����2��10-4mol��5����200��20��=0.01 mol�� Fe2+�����ʵ�����1.0 mol/L��0.1 L=0.1 mol����NiOOH��Ӧ��Fe2+�����ʵ�����0.1 mol-0.01 mol=0.09mol�����ݵ����غ��֪n��NiOOH��=0.09mol��m��NiOOH��=91.7 gmol^-1 ��0.09 mol=8.253g�� n[Ni(OH)2]= (9.18g8.253g)��92.7g/mol=0.01mol��x��y=n��NiOOH����n[Ni(OH)2]=0.09 mol��0.01 mol=9��1��
4NiOOH+2H2O����5������KmnO4���ʵ�����0.01 mol/L�� 0.02L =2��10-4mol����NiOOH��Ӧ��ʣ���Fe2+���ʵ�����2��10-4mol��5����200��20��=0.01 mol�� Fe2+�����ʵ�����1.0 mol/L��0.1 L=0.1 mol����NiOOH��Ӧ��Fe2+�����ʵ�����0.1 mol-0.01 mol=0.09mol�����ݵ����غ��֪n��NiOOH��=0.09mol��m��NiOOH��=91.7 gmol^-1 ��0.09 mol=8.253g�� n[Ni(OH)2]= (9.18g8.253g)��92.7g/mol=0.01mol��x��y=n��NiOOH����n[Ni(OH)2]=0.09 mol��0.01 mol=9��1��