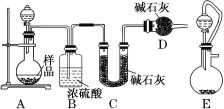
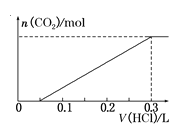
题目内容
【题目】科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图如图1可简单表示如下,其中配位键和氢键均采用虚线表示。
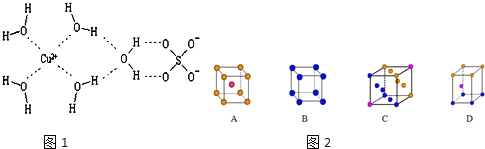
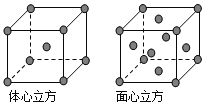
(1)金属铜采用下列______________堆积方式。
(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有______________(填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为______________;
(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色溶液.写出此蓝色沉淀溶解的离子方程式:______________;
(4)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色.该反应在有的教材中用方程式FeCl3+3KSCN═Fe(SCN)3+3KCl表示.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合.请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供______________,SCN-提供______________,二者通过配位键结合.
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色.含该离子的配合物的化学式是______________。
【答案】(1)C;
(2)①AC;②3:1;
(3)Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)①空轨道,孤对电子;② [Fe(SCN)]Cl2
【解析】
试题分析:(1)Cu为最密堆积,其配位数为12,只有C符合,故答案为:C;
(2)①[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,故答案为:AC;
②铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×![]() =3,晶胞中Au原子数目=8×
=3,晶胞中Au原子数目=8×![]() =1,故晶胞中Cu原子与Au原子数量之比为3:1,故答案为:3:1;
=1,故晶胞中Cu原子与Au原子数量之比为3:1,故答案为:3:1;
(3)氢氧化铜沉淀可以溶于过量的氨水中,反应的离子方程式为:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O,故答案为:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)①Fe3+与SCN-反应生成的配合物中,Fe3+提供空轨道,SCN-提供孤对电子,故答案为:空轨道,孤对电子;
②Fe3+与SCN-以个数比1:1配合所得离子为[Fe(SCN)]2+,所以FeCl3与KSCN在水溶液中反应生成[Fe(SCN)]Cl2与KCl,故答案为:[Fe(SCN)]Cl2。