题目内容
【题目】H2O2是一种常用绿色氧化剂,在化学研究中应用广泛
(1)常温下,用CO、O2和水在三苯基膦肥钯的催化下即可制得H2O2。相对于电解氢氧化钠溶液制H2O2,该方法的优点是最安全、___。
(2)图1是铝/过氧化氢电池结构示意图,铝电极为_________(填“正极”或“负极”)。石墨电极的电极反应式为_______________-
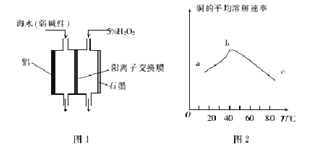
(3)印刷电路板中的金属铜可用10%的H2O2 溶液和0.3mol·L-1的H2SO4溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示,其中bc段曲线变化的主要原因是_________.
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验。将表中所给的溶液分别加入A、B、C、D4个反应瓶中,手机产生的气体,记录数据
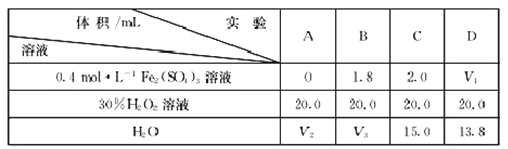
①记录的数据为__________。
②上表中的V3=__________。
【答案】(1)能耗低(其他合理答案均可)(2分);(2)负极(1分);H2O2+2e-==2OH-(2分);
(3)随着温度的升高,H2O2的分解速率加快(2分);
(4)①收集相同体积气体所需的时间(或相同时间内收集气体的体积)(1分);②15.2(2分)。
【解析】
试题分析:(1)电解法需消耗电能,而催化法常温下即可进行,而CO、O2和水在三苯基膦钯的催化下室温制得了H2O2,不需要额外提供能量,该方法的优点是最安全、能耗低;(2)铝较活泼,作负极,石墨作正极,双氧水得电子,氧的化合价降低,电极反应式为H2O2+2e-=2OH-;(3)图象显示,温度升高到40℃以后,铜的平均溶解速率降低,是因为双氧水不稳定,温度升高,分解速率加快,反应物双氧水的浓度降低,导致铜的平均溶解速率降低。故bc段曲线变化的主要原因是随着温度的升高,双氧水的分解速率加快;(4)①研究硫酸铁的量对过氧化氢分解速率的影响,需要记录收集相同体积气体所需的时间(或相同时间内收集气体的体积);②研究硫酸铁的量对过氧化氢分解速率的影响,其他条件要相同,所以让每次实验的总体积相同,从C中得出溶液的总体积为37.0mL,所以V3=37.0mL-1.8mL-20.0mL=15.2mL。