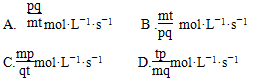题目内容
某温度下,向2L恒容密闭容器中充人1.0 mol A和1.0mol B,发生反应A(g)+ B(g) 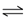 C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )

A.反应在前5s的平均速率V(A)=0.15 mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mo1· L-1,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的分解率大于80%
D.相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C反应达到平衡前反应速率V(正)<V(逆)
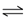 C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
A.反应在前5s的平均速率V(A)=0.15 mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mo1· L-1,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的分解率大于80%
D.相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C反应达到平衡前反应速率V(正)<V(逆)
D
试题分析:A、根据题给数据分析,反应在前5s的A的物质的量变化为0.15mol,根据公式v=△n/V△t计算,平均速率V(A)="0.015" mol/(L·s),错误;B、根据题给数据分析,反应达平衡时c(A)=0.4mol/L,保持其他条件不变,升高温度,平衡时c(A)=0.41mo1· L-1,说明平衡逆向移动,升高温度平衡向吸热反应方向移动,则反应的△H<0,错误;C、根据等效平衡知识判断,相同温度下,起始时向容器中充入2.0 mol C,相当于起始向容器中充人2.0 mol A和2.0mol B,相当于加压,平衡正向移动,结合题给数据分析,达到平衡时,C的分解率小于80%,错误;D、相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C反应达到平衡前,反应逆向进行,反应速率V(正)<V(逆),正确。

练习册系列答案
相关题目
 2XY2
2XY2 2X2Y
2X2Y 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
 yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
 2 CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2 CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。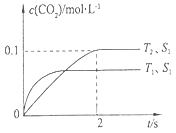

 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( ) 2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。