题目内容
【题目】氢气用于工业合成氨 N2(g)+3H2(g)2NH3(g);△H=﹣92.2kJmol﹣1 . 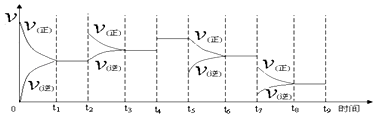
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如图所示,其中t4﹑t5﹑t7时刻对应的实验条件改变分别是
t4 .
t5 .
t7 .
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,此时放出热量46.1kJ.则n= .
【答案】加入催化剂;减小NH3浓度;降温;1
【解析】解:①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如图所示,其中t4﹑t5﹑t7时刻对应的实验条件改变分别是t4正逆反应速率同时增大相同的倍数,所以使用催化剂;t5时平衡正向移动,但逆反应的速率突然减小,所以减小生成物的浓度;t7时刻正逆反应速率都减小,且反应向正反应方向进行,说明是降低温度,平衡正向进行,
所以答案是:t4 加入催化剂;t5 减小NH3浓度;t7 降温;
②由反应方程式可知:N2(g)+3H2(g)2NH3(g);△H=﹣92.2kJmol﹣1,1mol的氮气与3mol的氢气完全反应放出92.2kJ的热量,而此时放出热量46.1kJ,所以参加反应的氮气的物质的量为 ![]() =0.5mol,即n×50%=0.5mol,解之得n=1mol,
=0.5mol,即n×50%=0.5mol,解之得n=1mol,
所以答案是:1.

 优生乐园系列答案
优生乐园系列答案【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO32- |
B |
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-lNaCl、NaI的混合溶液中滴加2滴0.01mol·L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D