题目内容
下图①表示向含MgCl2、AlCl3、NH4Cl三种物质的混合溶液中逐滴加入NaOH溶液时,沉淀的物质的量与NaOH溶液的体积关系;图②表示某反应过程中的能量关系。下列各表述与示意图不一致的是
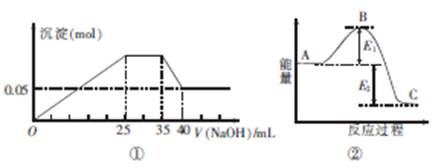

| A.图①中三种离子的物质的量之比n(Mg2+):n(Al3+):n(NH+4)=1:1:2 |
| B.图①中使用的NaOH的浓度为2 mol·L-1 |
| C.图②中若使用催化剂,B点会降低 |
| D.图②中若由物质C反应生成物质A,则反应的活化能为E1+E2 |
B
根据图①0—25mL是AL3+、Mg2+所消耗的NaOH;25—35mL是NH4+所消耗的NaOH;35—40mL是AL(OH)3所消耗的NaOH;Mg(OH)2沉淀的物质的量为0.05mol;
由离子方程式:Mg2++2OH-=Mg(OH)2↓;AL3++3OH-=AL(OH)3↓;NH4++OH-=NH3·H2O;
AL(OH)3+OH-=ALO2-+2H2O;可知,AL(OH)3消耗NaOH溶液5mL;则AL3+消耗消耗NaOH溶液15 mL,Mg2+消耗NaOH溶液10mL;所以可求得n(Mg2+):n(Al3+):n(NH+4)=1:1:2A对;c(NaOH)="10" mol·L-1;B错;使用催化剂会降低反应所需的活化能,B点降低,C对;D对。
由离子方程式:Mg2++2OH-=Mg(OH)2↓;AL3++3OH-=AL(OH)3↓;NH4++OH-=NH3·H2O;
AL(OH)3+OH-=ALO2-+2H2O;可知,AL(OH)3消耗NaOH溶液5mL;则AL3+消耗消耗NaOH溶液15 mL,Mg2+消耗NaOH溶液10mL;所以可求得n(Mg2+):n(Al3+):n(NH+4)=1:1:2A对;c(NaOH)="10" mol·L-1;B错;使用催化剂会降低反应所需的活化能,B点降低,C对;D对。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目


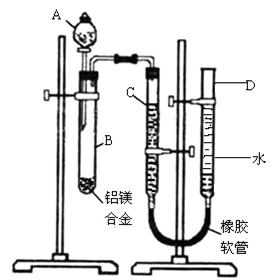
 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)