题目内容
【题目】Ⅰ.车用燃料技术的研究受到广泛关注,目前利用氢能的氢氧燃料电池技术较成熟。某兴趣小组想探究氢氧燃料电池反应的工作原理,设计如图(a)所示的实验装置。实验前,U 型管中装满溶液,电极均为铂电极。
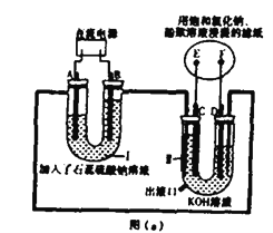
(1)I池为______(填“原电池”、“电解池”),判断A、B的电极名称的依据是:__________ B极的电极反应式:__________
(2)通电一段时间后,滤纸上发生明显颜色变化,则发生反应的化学方程式为___________
(3)Ⅱ池中电极具有导电和_______的作用,写出D的电极反应式:___________
Ⅱ.该兴趣小组查阅资料发现,现有的技术在原料氢气的储存和运输方面都存在安全隐患.2017年3月大连理工大学研究以“铂一碳化钼催化甲醇和水液化重组制备氢气”的新方法获得重大突破,并在美国《自然》杂志发表,具体原理如上图(b)所示:
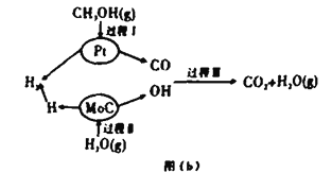
(4)过程Ⅱ属于_________(填“吸热”或“放热)过程。
(5)依据下表完成总反应的热化学方程式:____________
化学键 | C=O | H-H | C-O | H-O | C-H |
E/(kJ/mol) | 803 | 436 | 326 | 464 | 414 |
(6)天然气是一种清洁的化石燃料.也可以在一定的条件下与水反应产生CO2和H2,若生产等量氢气,则消耗甲醇和甲烷的质量比为:_________。
【答案】 电解池 因为I池实质是电解水,可观察“U”管两端生成气体的体积大小,判断产生体积大的为H2,即阴极。所以A为阴极、B极为阳极 2H2O﹣4e- ﹦O2↑+ 4 H+或4OH﹣﹣4e- ﹦O2↑﹢2H2O 2NaCl + 2H2O ![]() H2↑+ Cl2↑+ 2NaOH 催化 H2 ﹢2OH –﹣2e- ﹦2H2O 吸热 CH3OH(g)+H2O(g)═ CO2(g)+3H2(g)△H=﹢46.0 kJ·mol -1 8:3
H2↑+ Cl2↑+ 2NaOH 催化 H2 ﹢2OH –﹣2e- ﹦2H2O 吸热 CH3OH(g)+H2O(g)═ CO2(g)+3H2(g)△H=﹢46.0 kJ·mol -1 8:3
【解析】(1)根据图示,I池存在外接电源,为电解池,I池实质是电解水,可观察“U”管两端生成气体的体积大小,判断产生体积大的为H2,即阴极。所以A为阴极、B极为阳极,其中B极的电极反应式为2H2O﹣4e- ﹦O2↑+ 4 H+或4OH﹣﹣4e- ﹦O2↑﹢2H2O,故答案为:电解池;因为I池实质是电解水,可观察“U”管两端生成气体的体积大小,判断产生体积大的为H2,即阴极。所以A为阴极、B极为阳极;2H2O﹣4e- ﹦O2↑+ 4 H+或4OH﹣﹣4e- ﹦O2↑﹢2H2O;
(2)电解饱和食盐水的化学方程式为2NaCl + 2H2O ![]() H2↑+ Cl2↑+ 2NaOH,故答案为:2NaCl + 2H2O
H2↑+ Cl2↑+ 2NaOH,故答案为:2NaCl + 2H2O ![]() H2↑+ Cl2↑+ 2NaOH;
H2↑+ Cl2↑+ 2NaOH;
(3)I池生成的氢气和氧气通入Ⅱ池中形成原电池,在铂电极作催化剂时反应生成水,其中D为负极,电极反应式为H2 ﹢2OH –﹣2e- ﹦2H2O,故答案为:催化;H2 ﹢2OH –﹣2e- ﹦2H2O;
(4)根据图示,过程II为H2O(g)的催化分解,为吸热过程,故答案为:吸热;
(5)根据图示,CH3OH(g)和H2O(g)在铂一碳化钼催化作用下生成CO2(g)和H2(g)
反应的方程式为CH3OH+H2O→ CO2+3H2,根据△H=反应物的键能之和-生成物的键能之和=(414×3+326+464+2×464)kJ·mol -1-(803×2+436×3)kJ·mol -1=﹢46.0 kJ·mol -1,故答案为:CH3OH(g)+H2O(g)═ CO2(g)+3H2(g)△H=﹢46.0 kJ·mol -1;
(6)天然气是一种清洁的化石燃料.也可以在一定的条件下与水反应产生CO2和H2,反应的方程式为CH4+2H2O→CO2+4H2,CH3OH+H2O→ CO2+3H2,根据方程式可知,生产等量氢气,消耗的甲醇和甲烷的物质的量之比为![]() ,则质量之比为
,则质量之比为![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
