题目内容
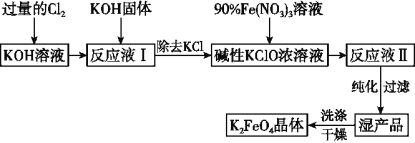
【题目】高铁酸钾(K2FeO4)是一种集强氧化性、吸附、絮凝于一体的新型多功能处理剂,其生产工艺如图所示:
已知K2FeO4具有下列性质:
①可溶于水、微溶于浓KOH溶液
②在0~5 ℃、强碱性溶液中比较稳定
③在Fe3+和Fe(OH)3催化作用下发生分解
④在酸性至碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,生产KClO应在温度___________的情况下进行(填“较高”或“较低”)。
(2)生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为______________。
(3)K2FeO4在弱碱性条件下能与水反应生成Fe(OH)3和O2,则该反应的化学方程式为________________。
(4)在“反应液Ⅰ”中加KOH固体的目的是___________。
A. 为下一步反应提供反应物
B. 与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO
C. KOH固体溶解时会放出较多的热量,有利于提高反应速率
D. 使副产物KClO3转化为KCl
(5)制备K2FeO4时,须将90%的Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌。采用这种混合方式的原因是_______________________ (答出1条即可)。
(6)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有________ (写化学式)。
(7)工业上常用“间接碘量法”测定高铁酸钾样品中高铁酸钾的含量,其方法是:用碱性的碘化钾溶液(pH为11~12)溶解3.96 g高铁酸钾样品,调节pH为1,避光放置40分钟至反应完全(高铁酸根离子全部被还原成铁离子),再调节pH为3~4(弱酸性)。以1.0 mol/L的硫代硫酸钠标准溶液为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),当达到滴定终点时,用去硫代硫酸钠标准溶液15.00 mL,则原高铁酸钾样品中高铁酸钾的质量分数为______________。
【答案】较低 3∶2 4K2FeO4+10H2O=8KOH+4Fe(OH)3↓+3O2↑ AB 减少K2FeO4在过量Fe3+作用下的分解(或K2FeO4在低温、强碱性溶液中比较稳定) KNO3、KCl 25%
【解析】
足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl,得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4。
(1)利用Fe(NO3)3与KClO制备K2FeO4,由信息可知温度较高KOH与Cl2 反应生成KClO3;
(2)根据电子守恒计算;
(3)K2FeO4在弱碱性条件下能与水反应生成Fe(OH)3和O2,利用元素守恒可写出化学方程式;
(4)根据生产工艺流程图,反应①中氯气过量,过量的Cl2与KOH继续反应,生成更多的KClO;
(5)由信息可知,K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解;
(6)根据生产工艺流程图,利用元素守恒可知,Fe(NO3)3与KClO在碱性条件下反应得溶液II中含有K2FeO4、KNO3和KCl;
(7)用碱性的碘化钾溶液溶解高铁酸钾样品,调节pH为1,高铁酸根与碘离子发生氧化还原反应,高铁酸根离子全部被还原成铁离子,碘离子被氧化成碘,根据电子得失守恒有关系2FeO42-~3I2,再根据反应2Na2S2O3+I2═Na2S4O6+2NaI,利用硫代硫酸钠的物质的量可计算得高铁酸钾的质量,进而确定质量分数。
足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下ClO-离子才能和Fe3+发生氧化还原反应生成FeO42-,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,根据电子得失守恒可知发生反应方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4。
(1)由工艺流程可知,利用Fe(OH)3与KClO制备K2FeO4,由信息可知温度较高KOH与Cl2反应生成的是KClO3,在低温下KOH与Cl2反应生成的是KClO,所以应选择低温较低;
(2)生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),Fe(NO3)3为还原剂,KClO为氧化剂,根据得失电子守恒可知,氧化剂与还原剂的物质的量之比为3:2;
(3)K2FeO4在弱碱性条件下能与水反应生成Fe(OH)3和O2,反应的化学方程式为4K2FeO4+10H2O=8KOH+4 Fe(OH)3↓+3O2↑;
(4)A.Fe(NO3)3与KClO反应时,要消耗KOH,A正确;
B.根据生产工艺流程图可知,第①步Cl2过量,加入KOH固体后会继续反应生成KClO,B正确;
C.因温度较高时KOH 与Cl2反应生成的是KClO3,而不是KClO,C错误;
D.KClO3转化为 KCl,化合价只降低不升高,不符合氧化还原反应原理,D错误;
(5)信息可知,K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,将90%的Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌,可以减少K2FeO4在过量Fe3+作用下的分解;
(6)根据生产工艺流程图,利用元素守恒可知,硝酸铁与次氯酸钾在碱性条件下反应得溶液II中含有高铁酸钾、硝酸钾和氯化钾,所以从溶液II中分离出K2FeO4后,同时得到副产品有KCl、KNO3;
(7)用碱性的碘化钾溶液溶解高铁酸钾样品,调节pH为1,高铁酸根与碘离子发生氧化还原反应,高铁酸根离子全部被还原成铁离子,碘离子被氧化成碘,根据电子得失守恒有关系2FeO42-~3I2,再根据反应2Na2S2O3+I2=Na2S4O6+2NaI,得关系式2FeO42-~3I2~6Na2S2O3,所以高铁酸钾的质量为![]() ×1.0mol/L×0.015L×198g/mol=0.99g,则原高铁酸钾样品中高铁酸钾的质量分数为
×1.0mol/L×0.015L×198g/mol=0.99g,则原高铁酸钾样品中高铁酸钾的质量分数为![]() ×100%=25%。
×100%=25%。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:

已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn | Pb | Cu | Cl | F |
质量分数% | 59.78 | 9.07 | 0.30 | 2.24 | 1.80 |
Ⅱ.浸出”时,大部分锌元素以Zn(NH3)42+形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)氨的电子式______________________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_________________________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol/L,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F-沉淀完全即溶液中c(F-)<10-5mol/L,则所加氯化钙溶液的浓度度最小为___________。已知:Ksp(CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭___________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)2Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为____________________________________________。
(6)“一次水解”时,产物为Zn(OH)xCly。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为___________。