题目内容
【题目】在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
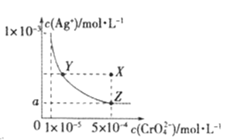
A.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
B.T℃时,在Y点和X点,水的离子积Kw相等
C.图中a=![]() ×10-4
×10-4
D.向饱和Ag2CrO4溶液中加入固体AgNO3能使溶液由Z点变为X点
【答案】D
【解析】
铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡方程式为Ag2CrO4(s)2Ag++CrO![]() ,结合Ksp=c2(Ag+)c(CrO
,结合Ksp=c2(Ag+)c(CrO![]() )分析解答。
)分析解答。
A.依据图象数据,曲线上的点是沉淀溶解平衡的点,Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)2Ag++CrO![]() ,Ksp=c2(Ag+)c(CrO
,Ksp=c2(Ag+)c(CrO![]() )=(10-3)2×10-5=10-11,故A正确;
)=(10-3)2×10-5=10-11,故A正确;
B.一定温度下水的离子积Kw是常数,只随温度变化,不随浓度变化,所以T℃时,Y点和X点时水的离子积Kw相等,故B正确;
C.依据溶度积常数计算Ksp(Ag2CrO4)=c2(Ag+)c(CrO![]() )=1×10-11,Z点时c(CrO
)=1×10-11,Z点时c(CrO![]() )=5×10-4,则c(Ag+)2=2×10-8,所以a=
)=5×10-4,则c(Ag+)2=2×10-8,所以a=![]() ×10-4,故C正确;
×10-4,故C正确;
D.在饱和Ag2CrO4溶液中加入AgNO3固体,Ag2CrO4(s)2Ag++CrO![]() 平衡逆向移动,移动后,仍存在Ag2CrO4(s)2Ag++CrO
平衡逆向移动,移动后,仍存在Ag2CrO4(s)2Ag++CrO![]() ,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入AgNO3固体不能使溶液由Z点变为X点,故D错误;
,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入AgNO3固体不能使溶液由Z点变为X点,故D错误;
故选D。

 阳光课堂课时作业系列答案
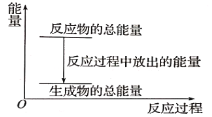
阳光课堂课时作业系列答案【题目】(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图示,然后回答问题:
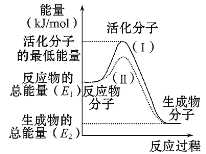
①图中所示反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=____ (用含E1、E2的代数式表示)。
②由上图可知曲线Ⅱ较曲线Ⅰ低,这是由于________。
(2)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)![]() CH3OH(g)ΔH1 ②CO2(g)+3H2(g)
CH3OH(g)ΔH1 ②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g)
CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3。已知反应①中相关的化学键键能数据如下:
CO(g)+H2O(g)ΔH3。已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/ kJ·mol-1 | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1= _____kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=___kJ·mol-1。