题目内容
【题目】Ⅰ.已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如图所示.(部分生成物和反应条件已略去)
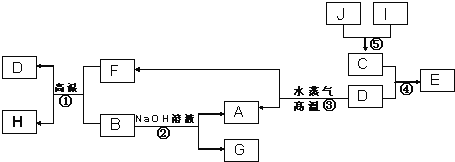
请回答下列问题:
(1)写出组成物质D的元素在周期表中的位置:_________________。
(2)写出反应②的化学方程式:___________________。
(3) J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________。
Ⅱ.某无色溶液,其中可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
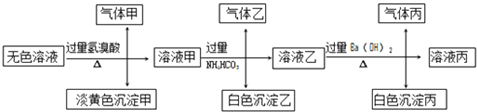
回答下列问题:
(4)生成沉淀甲的离子方程式:__________________;
(5)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
步骤 | 实验目的 | 试剂 | 现象 |
1 | |||
2 | |||
3 | |||
4 |
(6)针对溶液中可能存在的离子,用实验验证其是否存在的方法是_______________。
【答案】
(1)第四周期第Ⅷ族;
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(4)2S2-+SO32-+6H+=3S↓+3H2O;
(5)检验SO2、除尽SO2、检验CO2(其它合理答案也给分)
步骤 | 实验目的 | 试剂 | 现象 |
1 | 检验SO2 | 品红溶液 | 红色退去 |
2 | 除尽SO2 | 酸性高锰酸钾溶液 | 紫色变浅或不完全褪去 |
3 | 检验CO2 | 澄清石灰水 | 变浑浊 |
(6)取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。(答案合理给分)
【解析】
试题分析:I的浓溶液具有还原性,应为HCl,J是一种黑色固体,可与浓盐酸反应,应为MnO2,二者反应生成C为Cl2,D为常见金属,可与水蒸气反应,应为Fe,则E为FeCl3,A为H2,F为Fe3O4,B能与Fe3O4在高温下反应,且能与NaOH溶液反应,则B为Al,G为NaAlO2,H为Al2O3,
(1)D为Fe,位于周期表第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH- +2H2O = 2AlO2- +3H2↑,故答案为:2Al+2OH- +2H2O = 2AlO2- +3H2↑;
(3)根据题意可知反应的离子方程式为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,故答案为:MnO2+H2O2+2H+=Mn2++O2↑+2H2O;
(4)Ag+与题目所给的所以阴离子都能反应,不能大量共存,所以原溶液不含Ag+,所以淡黄色沉淀甲不是AgBr,为SO32与S2在酸性条件下反应生成的S单质沉淀,所以离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;气体甲由两种氧化物组成(不包括水蒸汽和HBr),因为氢溴酸为强酸,能与CO32和SO32反应生成CO2和SO2气体,所以气体甲含有的两种氧化物为SO2和CO2,首先利用SO2的漂白性,通入品红溶液检验SO2,为了防止SO2对CO2检验的干扰,第2步应利用SO2的还原性,通入酸性KMnO4除去SO2,然后再通入澄清石灰水,检验CO2的存在,故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
步骤 | 实验目的 | 试剂 | 现象 |
1 | 检验SO2 | 品红溶液 | 红色褪去 |
2 | 除尽SO2 | 酸性高锰酸钾溶液 | 紫色变浅或不完全褪去 |
3 | 检验CO2 | 澄清石灰水 | 变浑浊 |
(5)因为Ba2+、Al3+不能与CO32、SO32共存,所以加入NH4HCO3后产生白色沉淀,说明原溶液含有AlO2-,加入过量氢溴酸后,转化为Al3+,Al3+与HCO3反应生成Al(OH)3沉淀,离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
(6)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,故答案为:取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。

 阅读快车系列答案
阅读快车系列答案