题目内容
14.某密闭容器中有如下可逆反应:A(气)+2B(气)?2C(气)(正反应放热),达到平衡后,若改变反应条件将变化的情况填入空格:(填增大、减小、不变)(1)升高温度,B的转化率减小,v(正)增大,v(逆)增大.
(2)加入催化剂,A的物质的量不变.
(3)缩小容器的体积,则C的物质的量增大,A的转化率增大.
(4)若温度和体积不变,反应从A、B起达到平衡,在这个变化过程中,容器内混合气体的总质量不变,容器内压强减小.
分析 (1)反应是放热反应,升温化学反应速率增大,平衡向吸热反应方向进行;
(2)加入催化剂改变反应速率,不改变化学平衡;
(3)缩小容器体积增大压强平衡正向进行;
(4)根据该反应的正方向为质量不变气体体积减小的可逆反应分析.
解答 解:(1)升高温度,正逆反应速率都增大,由于正反应放热,则升高温度平衡向逆反应方向移动,B的转化率减小;
故答案为:减小;增大;增大;
(2)加入正催化剂,正逆反应速率都增大,平衡不移动,A的物质的量不变,故答案为:不变;
(3)缩小容器的体积,增大压强,平衡正向进行,则C的物质的量增大,A的转化率增大,故答案为:增大;增大;
(4)若温度和体积不变,反应从A、B起达到平衡,在这个变化过程中,因为反应前后质量不变,所以容器内混合气体的总质量不变,反应后气体体积减小,所以容器内压强减小,故答案为:不变;减小.
点评 本题考查了化学平衡移动原理的分析判断,注意反应特征和移动原理的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
5.下列溶液中的NO3-离子浓度与500mL l mol•L-1NaNO3中的NO3-浓度相等的是( )
| A. | 100mL2mol•L-1NH4NO3溶液 | B. | 40mL0.5mol•L-1Ca(NO3)2溶液混合 | ||
| C. | 50mLl.5mol•L-1Al(NO3)3溶液 | D. | 150mL1mol•L-1Mg(NO3)2溶液 |
9.下列说法正确的是( )
| A. | 第三周期非金属元素的含氧酸的酸性从左到右依次增强 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从上到下依次减弱 | |
| C. | 在ⅥA族元素的氢化物(H2R)中,沸点最高的一定是无毒的 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点也一定越高 |
19.由两种原子组成的纯净物( )
| A. | 一定是化合物 | B. | 可能是化合物,也可能是单质 | ||
| C. | 一定是单质 | D. | 一定是同素异形体 |

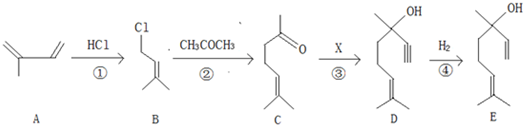
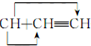 →CH≡C-CH═CH2
→CH≡C-CH═CH2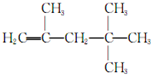 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是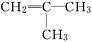 ,丙的结构简式是
,丙的结构简式是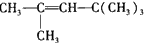 .
.
 .
.