题目内容
2.海水是一个巨大的化学资源宝库.(1)海底蕴含着储量巨大的甲烷水合物,CH4被认为是21世纪新型洁净的能源.在25℃、101kPa时,16g CH4气体完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)?CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)下列关于甲烷燃烧的说法正确的是AB(填序号).
A.天然气属于化石燃料,属于不可再生的能源
B.该反应中,反应物所具有的总能量高于生成物所具有的总能量
C.25℃、101kPa 时,16g的CH4完全燃烧生成气态水时放出的热量大于890.31kJ.
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)A、化石燃料属于不可再生的能源
B、甲烷燃烧是放热反应,结合能量守恒分析判断物质的能量变化;
C、液态水变化为气态水吸热,反应放出热量数值减小,焓变为负值比较大小.
解答 解:(1)16g即1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol;
(2)A、天然气属于化石燃料,属于不可再生的能源,故A正确;
B、甲烷燃烧是放热反应,结合能量守恒分析,反应物能量高于生成物,故B正确;
C、液态水变化为气态水吸热,反应放出热量数值减小,焓变为负值比较大小,25℃、101kPa 时,16g的CH4物质的量为=$\frac{16g}{16g/mol}$=1mol,完全燃烧生成气态水时放出的热量小于890.31kJ,故C错误;
故答案为:AB.
点评 本题主要考查了热化学方程式的书写,题目难度不大,注意物质的量与热量成正比是解题的关键.注意标注物质聚集状态和对应焓变.

练习册系列答案
相关题目
12. A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨、光化学烟雾等(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=3NaOH+NH3•H2O.
(4)A的气态氢化物和 D的气态氢化物在空气中相遇时的现象是有白烟产生.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨、光化学烟雾等(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=3NaOH+NH3•H2O.
(4)A的气态氢化物和 D的气态氢化物在空气中相遇时的现象是有白烟产生.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
13.无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2、HCl中的某几种.将100mL甲气体经过右图实验的处理,结果得到酸性溶液,且最终几乎无气体剩余.则甲气体的组成为( ) 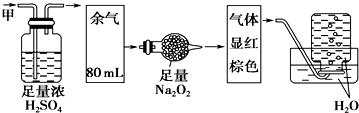

| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | HCl、NO2、CO2 | D. | NO、CO2、N2 |
10.在蒸馏实验中,下列仪器不需要用到的是( )
| A. | 锥形瓶 | B. | 酒精灯 | C. | 蒸发皿 | D. | 石棉网 |
17.已知反应A2(g)+2B2(g)?2AB2(g)△H<0,达到平衡后,改变条件,下列说法正确的是( )
| A. | 增加A2 的浓度,有利于该反应平衡逆向移动 | |
| B. | 升高温度有利于该反应平衡正向移动 | |
| C. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| D. | 增大压强有利于该反应平衡正向移动 |
11.在高温下,用一氧化碳还原m g氧化铁,得到n g铁,已知氧的相对原子质量为16,则铁的相对原子质量为( )
| A. | $\frac{24n}{m-n}$ | B. | $\frac{n}{24(m-n)}$ | C. | $\frac{m-n}{8}$ | D. | $\frac{2(m-n)}{3n}$ |
11.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的气化和石油的分馏均属物理变化 | |
| B. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
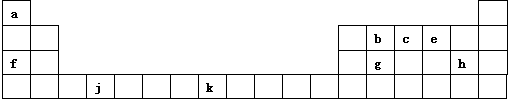
 ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则.