题目内容
5.下列溶液中的NO3-离子浓度与500mL l mol•L-1NaNO3中的NO3-浓度相等的是( )| A. | 100mL2mol•L-1NH4NO3溶液 | B. | 40mL0.5mol•L-1Ca(NO3)2溶液混合 | ||
| C. | 50mLl.5mol•L-1Al(NO3)3溶液 | D. | 150mL1mol•L-1Mg(NO3)2溶液 |
分析 根据溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算NO3-的物质的量浓度,与溶液的体积无关,20mL1mol•L-1NaNO3溶液中NO3- 物质的量浓度=1mol/L×1=1mol/L.
解答 解:500mL l mol•L-1NaNO3中的NO3-浓度为1mol/L,
A、100mL2mol/NH4NO3溶液中NO3- 物质的量浓度=2mol/L.
B、40mL0.5mol•L-1Ca(NO3)2溶液中NO3- 物质的量浓度=0.5mol/L×2=1mol/L.
C、50mLl.5mol•L-1Al(NO3)3溶液中NO3- 物质的量浓度=1.5mol/L×3=4.5mol/L.
D、150mL1mol•L-1Mg(NO3)2溶液中NO3- 物质的量浓度=1mol/L×2=2mol/L.
故选B.
点评 本题考查了离子浓度的计算,明确“溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算氯离子的物质的量浓度,与溶液的体积无关”是解本题的关键,难度不大.

练习册系列答案
相关题目
16.标准状况下,用充满干燥混合的N2、NO2的烧瓶做喷泉实验,最后烧瓶中液体为容积的一半,则所得溶液的物质的量浓度为( )
| A. | 1mol/L | B. | 0.1mol/L | C. | 0.45mol/L | D. | 0.045mol/L |
13.无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2、HCl中的某几种.将100mL甲气体经过右图实验的处理,结果得到酸性溶液,且最终几乎无气体剩余.则甲气体的组成为( ) 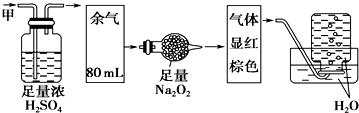

| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | HCl、NO2、CO2 | D. | NO、CO2、N2 |
20.下列表述中正确的是( )
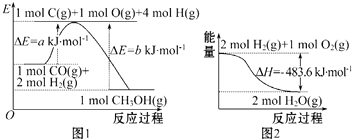

| A. | 根据图 1 可知合成甲醇的热化学方程式为CO(g)+2H2 (g)=CH 3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 图 2 表示 2 mol H2(g)所具有的能量比 2 mol气态水所具有的能量多 483.6 kJ | |
| C. | 1 mol NaOH 分别和 1 mol CH3COOH、1 mol HNO3 反应,后者比前者△H 小 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
10.在蒸馏实验中,下列仪器不需要用到的是( )
| A. | 锥形瓶 | B. | 酒精灯 | C. | 蒸发皿 | D. | 石棉网 |
17.已知反应A2(g)+2B2(g)?2AB2(g)△H<0,达到平衡后,改变条件,下列说法正确的是( )
| A. | 增加A2 的浓度,有利于该反应平衡逆向移动 | |
| B. | 升高温度有利于该反应平衡正向移动 | |
| C. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| D. | 增大压强有利于该反应平衡正向移动 |
14.下列叙述正确的是( )
| A. | 同主族金属元素的原子半径越大,熔点越高 | |
| B. | 离子晶体固态或熔融状态下都能导电 | |
| C. | 原子最外层有3个电子的元素一定是主族元素 | |
| D. | 温度越高,金属晶体的导电性越好 |
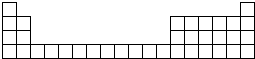 如图为元素周期表中前4周期的表格.甲是一种常见化合物,其化学式为XC13.
如图为元素周期表中前4周期的表格.甲是一种常见化合物,其化学式为XC13.