题目内容
1.已知白磷(P4)与CuSO4溶液反应的化学方程式为(Cu3P中P的化合价为-3价):11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,则2molCuSO4能氧化白磷的物质的量是( )| A. | $\frac{1}{20}$mol | B. | $\frac{1}{10}$mol | C. | $\frac{1}{5}$mol | D. | $\frac{2}{5}$mol |
分析 Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,结合电子守恒来解答.
解答 解:Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,
则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为$\frac{1mol×(2-1)}{4×(5-0)}$=$\frac{1}{20}$mol,则2molCuSO4能氧化白磷的物质的量是$\frac{1}{10}$mol,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度不大.

练习册系列答案
相关题目
12.下列表达式正确的是( )
| A. | 碳原子的L层电子轨道表示式: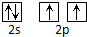 | |
| B. | 氯化氢的电子式: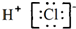 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:${\;}_{6}^{12}$C |
9.下列反应必须加入氧化剂且一步反应就能完成的是( )
| A. | N2→NH3 | B. | N2→NO | C. | N2→NO2 | D. | NO2→NO |
16.氮元素的化合物种类繁多,性质也各不相同
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
①反应开始直至10min时,N2O4的平均反应速率为:0.0025mol/L•min
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| n(NO2)/mol | 0.400 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
10.X,Y都是短周期元素,X原子的最外层上有4个电子,Y原子的最外层上有6个电子,则X与Y形成化合物的化学式可能为( )
| A. | XY2 | B. | X2Y4 | C. | YX2 | D. | XY |
11.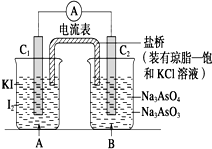 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%NaOH溶液
结果发现电流表指针均发生偏转.据此,下列判断正确的是( )
 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%NaOH溶液
结果发现电流表指针均发生偏转.据此,下列判断正确的是( )
| A. | 操作Ⅰ过程中,C1为正极 | |
| B. | 操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 | |
| C. | Ⅰ操作过程中,C2棒上发生的反应为AsO${\;}_{4}^{3-}$+2H++2e-=AsO${\;}_{3}^{3-}$+H2O | |
| D. | Ⅱ操作过程中,C1棒上发生的反应为2I--2e-=I2 |
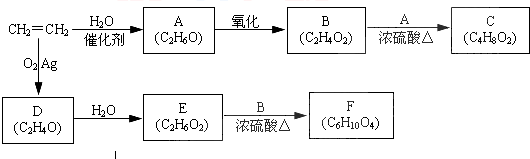
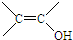 、
、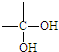 结构非常不稳定,会迅速转变为
结构非常不稳定,会迅速转变为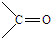
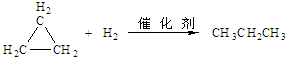
 .
.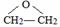 .
.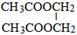 .
.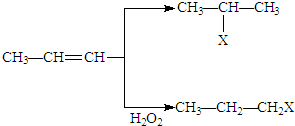 (X为卤素原子)
(X为卤素原子)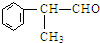 的物质,该物质是一种香料.
的物质,该物质是一种香料.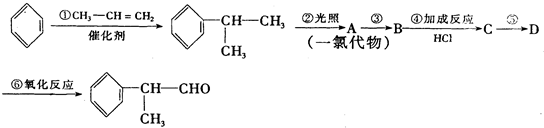
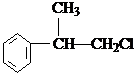 、
、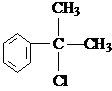 .
.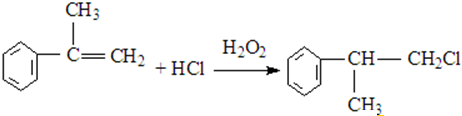 .
. 、
、 、
、 任意2种.
任意2种.