题目内容
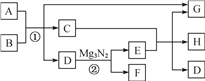
【题目】用游离态的氮经一系列转化可制得硝酸,如下图所示。

(1)氨与氧气生成一氧化氮反应的化学方程式是______________。
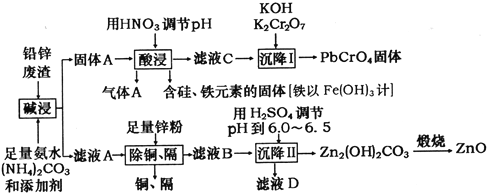
(2)在800℃时,向容积为1L的密闭容器中充入0.020 mol NO和0.010 mol O2,发生反应2NO(g)+O2(g)![]() 2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。
2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。
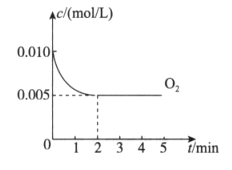
①2min时,c(NO2)=_________mol/L。
②800℃时,该反应的化学平衡常数数值是__________。
③已知:
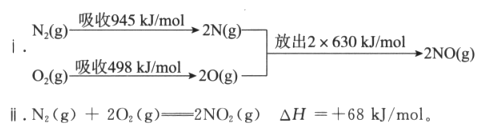
NO生成NO2热化学方程式是_________。为了提高NO的转化率可以采取的措施有__________。
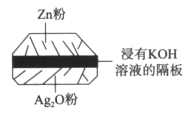
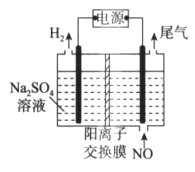
(3)可用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。电解过程中NO转化为硝酸的电极反应式是__________。若处理标准状况下448 L的NO,则可得到质量分数为63%的HNO3溶液的质量是____________。
【答案】 4NH3+5O2 ![]() 4NO+6H2O 0.01 200 2NO(g)+O2(g)
4NO+6H2O 0.01 200 2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]() kJ/mol 适当降低温度,增大氧气浓度 NO-3e-+2H2O=NO
kJ/mol 适当降低温度,增大氧气浓度 NO-3e-+2H2O=NO![]() +4H+ 2kg
+4H+ 2kg
【解析】(1)氨与氧气催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2 ![]() 4NO+6H2O;(2)①由图象可知O2浓度的变化计算v(O2)=
4NO+6H2O;(2)①由图象可知O2浓度的变化计算v(O2)=![]() ,v(NO)=2 v(O2)=
,v(NO)=2 v(O2)=![]() ;
;
② 2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
起始浓度 0.01 0.005 0
平衡浓度 0.005 0.0025 0.005
则k=![]() ;③i.N2(g)+O2(g)=2NO(g)△H=(945kJ/mol+498kJ/mol)-2×630KJ/mol=+183kJ/mol,
;③i.N2(g)+O2(g)=2NO(g)△H=(945kJ/mol+498kJ/mol)-2×630KJ/mol=+183kJ/mol,
ii.N2(g)+2O2(g)═2NO2(g)△H=+68kJ/mol
则盖斯定律ii-i得到2NO(g)+O2(g)=2NO2(g)△H=-115 kJ/mol,为了提高NO的转化率必须使平衡正向移动,反应为放热反应,可适应降低温度,或增大增大氧气浓度;(3)电解过程中NO转化为硝酸的电极反应式为:NO-3e-+2H2O=![]() +4H+,根据反应可知,若处理标准状况下448L的NO为20mol,则可得到质量分数为63%的HNO3溶液的质量是
+4H+,根据反应可知,若处理标准状况下448L的NO为20mol,则可得到质量分数为63%的HNO3溶液的质量是![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)已知破坏1mol共价键需要的能量如表所示
H-H | N-H | N-N | N≡N |
435.5kJ | 390.8kJ | 163kJ | 945.8kJ |
则△H=__________。
(2)在恒温、恒压容器中,按体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将__________(填“增大”、“减小”、或“不变”,后同);若在恒温、恒容条件下c(N2)/c(NH3)将________。
(3)在不同温度、压强和使用相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol 时,平衡混合物中氨的体积分数(φ)如图所示。
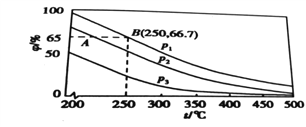
①其中,p1、p2和p3由大到小的顺序是_______,原因是___________________。
②若在250℃、p1条件下,反应达到平衡时的容器体积为1L,则该条件下合成氨的平衡常数K=____(结果保留两位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
①每生成34g NH3的同时消耗44g CO2 ②混合气体的密度保持不变
③NH3的体积分数保持不变 ④混合气体的平均相对分子质量不变 ⑤c(NH3):c(CO2)=2:1
(5)科学家发现,N2和H2组成的原电池合成氨与工业合成氨相比具有效率高,条件易达到等优点。其装置如图所示、写出该原电池的电极反应:________________、_____________,若N2来自于空气,当电极B到A间通过2molH+时理论上需要标况下空气的体积为_________(结果保留两位小数)。