题目内容
【题目】SO2是高中化学重点学习大三大气体之一,是常见的大气污染物之一,同时有是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
①请在下表空白处填写相关实验现象。
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
②设计实验1的目的是_________。
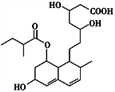
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲所示。实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
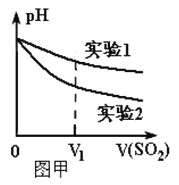
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

(1)若原料气从左向右流时,上述装置连接的顺序是:原料气→______ (用字母和箭头表示)。当装置②中出现_______现象时,立即停止通气。
(2)你认为下列试剂中,可以用来代替试管中的酸性KMnO4溶液的是________。(填字母代号)
A.NaOH溶液 B.溴水 C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行定性测定。
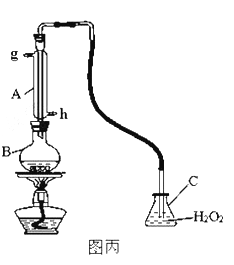
(1)B中加入250.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____。
【答案】 无明显现象 有白色沉淀产生 做对比实验 3SO3+2NO3-+3Ba2++2H2O=3BaSO4↓ +4H++2NO↑(或3H2SO4+2NO3-+3Ba2+=2NO↑+3BaSO4↓+4H++H2O) c→d→b→a→e 溶液紫(或紫红)色褪去 B 0.288 盐酸的挥发性;不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响
【解析】Ⅰ.(1)根据强酸制弱酸的原理,亚硫酸是弱酸不能制备盐酸,故实验1无明显现象,SO2溶于水后生成H2SO3,亚硫酸显酸性,电离出H+,和NO3-结合生成硝酸,具有强氧化性,将SO32-氧化成SO42-,故生成白色的BaSO4沉淀;(2)实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体,实验2:在盛有富含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体,对比实验观察反应现象确定硝酸根在酸溶液中具有氧化性,故为做对比实验;(2)实验1中,SO2溶于水后生成H2SO3,H2SO3![]() H++ HSO3-、HSO3-
H++ HSO3-、HSO3-![]() H++ SO32-,所以溶液pH值减小,实验2发生反应:3SO2+2NO3-+2H2O=3SO42-↓+4H++2NO,把门反应中生成了强酸硫酸,则实验2的pH小于实验1,答案为:3SO3+2NO3-+3Ba2++2H2O=3BaSO4↓+4H++2NO↑或3H2SO4+2NO3-+3Ba2+=2NO↑+3BaSO4↓+4H++H2O;
H++ SO32-,所以溶液pH值减小,实验2发生反应:3SO2+2NO3-+2H2O=3SO42-↓+4H++2NO,把门反应中生成了强酸硫酸,则实验2的pH小于实验1,答案为:3SO3+2NO3-+3Ba2++2H2O=3BaSO4↓+4H++2NO↑或3H2SO4+2NO3-+3Ba2+=2NO↑+3BaSO4↓+4H++H2O;
Ⅱ. (1)原料气通过高锰酸钾溶液,能氧化亚硫酸,生成硫酸,吸收二氧化硫气体,通过装置①③排水量气测定仪器和氮气的体积;装置②是吸收二氧化硫气体,高锰酸钾溶液为紫色,全部反应紫色褪去,应停止通气,连接装置接口顺序为:c→d→b→a→e,装置②是吸收二氧化硫气体,高锰酸钾溶液为紫色,全部反应紫色褪去,应停止通气,否则二氧化硫吸收不完全,造成误差;(2)二氧化硫具有还原性,可以利用高锰酸钾溶液吸收,且现象明显,A、氢氧化钠虽然能吸收二氧化硫气体但无明显现象,选项A不选;B、溴水可以吸收二氧化硫,溶液棕红色褪去,现象明显,选项B选;C、氨水可以吸收二氧化硫,但现象不明显,选项C不选;D、BaCl2溶液不能吸收二氧化硫,选项D不选。答案选B;
Ⅲ. (1)根据2NaOH![]() H2SO4
H2SO4![]() SO2可知SO2的质量为:
SO2可知SO2的质量为: ![]() ×(0.0900mol/L×0.025L)×64g/mol=0.072g该葡萄酒中的二氧化硫含量为
×(0.0900mol/L×0.025L)×64g/mol=0.072g该葡萄酒中的二氧化硫含量为![]() =0.288g/L;(2)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响。
=0.288g/L;(2)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响。