题目内容
【题目】环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定的空气质量信息,这些污染物是( )
A. 二氧化硫、氮氧化物、一氧化碳、可吸入颗粒物
B. 二氧化硫、氮氧化物、二氧化碳、可吸入颗粒物
C. 稀有气体、氮氧化物、一氧化碳、可吸入颗粒物
D. 稀有气体、氮氢化物、一氧化碳、可吸入颗粒物
【答案】A
【解析】二氧化碳、稀有气体不属于空气污染物,故A正确。

【题目】SO2是高中化学重点学习大三大气体之一,是常见的大气污染物之一,同时有是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
①请在下表空白处填写相关实验现象。
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
②设计实验1的目的是_________。
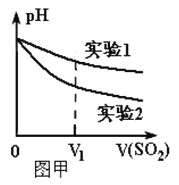
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲所示。实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
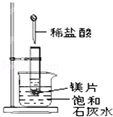
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

(1)若原料气从左向右流时,上述装置连接的顺序是:原料气→______ (用字母和箭头表示)。当装置②中出现_______现象时,立即停止通气。
(2)你认为下列试剂中,可以用来代替试管中的酸性KMnO4溶液的是________。(填字母代号)
A.NaOH溶液 B.溴水 C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行定性测定。
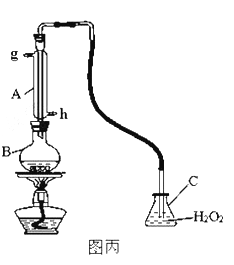
(1)B中加入250.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____。
【题目】根据表(部分短周期元家的原子半径及主要化合价)信息,完成有关问题:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、﹣2 | ﹣2 |
(1)A、B、D、E的简单离子半径由大到小的顺序是(用具体离子符号表示);
(2)B单质和C单质的化学性质相似,试写出C单质与强碱溶液反应的离子方程式;
(3)D和E组成的两种化合物中具有漂白性的是 , 该化合物转化为另一种化合物的化学方程式为;
(4)已知A的氢化物能与水反应生成一种可燃性气体和一种强碱,试写出该反应的化学方程式 .