题目内容
无机化合物A中含有金属Li元素,遇水强烈水解,主要用于有机合成和药物制造,是具有良好前景的储氢材料。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。
回答下列问题:
(1)A的化学式是 , C的电子式是 。
(2)写出化合物A与盐酸反应的化学方程式: 。
(3)某同学通过查阅资料得知物质A的性质:
Ⅰ.工业上可用金属D与液态的C在硝酸铁催化下反应来制备A物质,纯净的A物质为白色固体,但制得的粗品往往是灰色的。
Ⅱ.物质A熔点390℃,沸点430℃,密度大于苯或甲苯,不溶于煤油,遇水反应剧烈,也要避免接触酸和酒精。在空气中化合物A缓慢分解,对其加强热则猛烈分解,但不会爆炸.在750~800℃分解为化合物E和气体C。
①物质A在750~800℃分解的方程式为: 。
②久置的物质A可能大部分变质而不能使用,需将其销毁。遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理 。
(4)工业制备单质D的流程图如下:

①步骤①中操作名称: 。
②试用平衡原理解释步骤②中减压的目的: 。
回答下列问题:
(1)A的化学式是 , C的电子式是 。
(2)写出化合物A与盐酸反应的化学方程式: 。
(3)某同学通过查阅资料得知物质A的性质:
Ⅰ.工业上可用金属D与液态的C在硝酸铁催化下反应来制备A物质,纯净的A物质为白色固体,但制得的粗品往往是灰色的。
Ⅱ.物质A熔点390℃,沸点430℃,密度大于苯或甲苯,不溶于煤油,遇水反应剧烈,也要避免接触酸和酒精。在空气中化合物A缓慢分解,对其加强热则猛烈分解,但不会爆炸.在750~800℃分解为化合物E和气体C。
①物质A在750~800℃分解的方程式为: 。
②久置的物质A可能大部分变质而不能使用,需将其销毁。遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理 。
(4)工业制备单质D的流程图如下:

①步骤①中操作名称: 。
②试用平衡原理解释步骤②中减压的目的: 。
(1)LiNH2 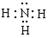
(2)LiNH2 +2HCl ="LiCl" + NH4Cl
(3)①3LiNH2 Li3N + 2NH3↑
Li3N + 2NH3↑
② LiNH2密度大于苯或甲苯且不溶于它们,所以可用苯或甲苯进行覆盖;乙醇可以跟LiNH2反应,方程式为:LiNH2+C2H5OH C2H5 OLi + NH3可将其销毁。
C2H5 OLi + NH3可将其销毁。
(4)①蒸发浓缩、冷却结晶
② LiCl﹒H2O(S)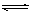 LiCl (s) + H2O(g) 减小压强,有利于上述平衡向正方向移动,有利于无水LiCl的制备。
LiCl (s) + H2O(g) 减小压强,有利于上述平衡向正方向移动,有利于无水LiCl的制备。
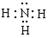
(2)LiNH2 +2HCl ="LiCl" + NH4Cl
(3)①3LiNH2
 Li3N + 2NH3↑
Li3N + 2NH3↑② LiNH2密度大于苯或甲苯且不溶于它们,所以可用苯或甲苯进行覆盖;乙醇可以跟LiNH2反应,方程式为:LiNH2+C2H5OH
 C2H5 OLi + NH3可将其销毁。
C2H5 OLi + NH3可将其销毁。(4)①蒸发浓缩、冷却结晶
② LiCl﹒H2O(S)
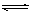 LiCl (s) + H2O(g) 减小压强,有利于上述平衡向正方向移动,有利于无水LiCl的制备。
LiCl (s) + H2O(g) 减小压强,有利于上述平衡向正方向移动,有利于无水LiCl的制备。试题分析:(1)由题给的信息:“已知无机化合物A中含有Li元素,遇水强烈水解”,“在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。”可推知C为NH3,并依据电解熔融的金属氯化物可以得到金属单质和氯气的知识,可推知B为LiCl。则固体A与NH4Cl固体反应可表为:A+ NH4Cl — LiCl + NH3,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,反应生成的LiCl也应为0.1mol,那么化合物A中含Li元素也为0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),就可推出该反应的化学方程式为应:LiNH2 + NH4Cl =" LiCl" + NH3,由此可知A是LiNH2,LiNH2的摩尔质量为23.0g/mol,2.30g LiNH2为0.1mol,符合化学反应方程式中的化学计量数, NH3分子的电子式为:
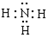
(2)根据化合物A(LiNH2)遇水强烈水解,能生成LiOH和NH3,所以其与盐酸反应的应为:LiNH2 +2HCl ="LiCl" + NH4Cl。
(3)①根据质量守恒(原子守恒),即可推出LiNH2在750~800℃分解的方程式为:3LiNH2
 Li3N + 2NH3↑。
Li3N + 2NH3↑。②由题给的LiNH2有关性质,用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇销毁变质的LiNH2的化学原理是“LiNH2密度大于苯或甲苯,且不溶于它们,所以可用苯或甲苯进行覆盖;乙醇可以跟LiNH2反应:LiNH2+C2H5OH
 C2H5OLi + NH3,可将其销毁。”这里必须注意,应回答的是解释其化学原理,而不是解释其原因。
C2H5OLi + NH3,可将其销毁。”这里必须注意,应回答的是解释其化学原理,而不是解释其原因。(4)通过工业制备单质Li的流程图可知:①步骤①是要从LiCl溶液获得LiCl﹒H2O晶体,所以,其操作应为:蒸发浓缩、冷却结晶、过滤、洗涤。步骤①中的操作己经有过滤、洗涤,还应有“蒸发浓缩、冷却结晶”。
②步骤②是要将LiCl﹒H2O晶体在减压、干燥的氯化氢气氛中加热(200℃)生成无水LiCl,然后经步骤③电解熔融的LiCl制得金属Li。因此根据LiCl﹒H2O晶体脱去结晶水生成无水LiCl的反应:LiCl﹒H2O(S)
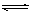 LiCl (s) + H2O(g),是一个扩大气体体积的反应,所以减小压强,有利于平衡LiCl﹒H2O(S)
LiCl (s) + H2O(g),是一个扩大气体体积的反应,所以减小压强,有利于平衡LiCl﹒H2O(S)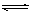 LiCl (s) + H2O(g)向正方向移动,有利于无水LiCl的制备。
LiCl (s) + H2O(g)向正方向移动,有利于无水LiCl的制备。
练习册系列答案
相关题目


 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.


 Cr2(SO4)3
Cr2(SO4)3