题目内容
两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42—,若将2.83 g X中的Cr3+全部氧化为Cr2O72—后,溶液中的Cr2O72—可和过量KI溶液反应,得到3.84 g I2。反应的离子方程式为Cr2O72—+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀,由此可推断出X的化学式为( )
| A.K2SO4·Cr2(SO4)3 | B.2K2SO4·Cr2(SO4)3 |
| C.K2SO4·2Cr2(SO4)3 | D.K2SO4· Cr2(SO4)3 Cr2(SO4)3 |
A
由Cr2O72—和足量KI溶液反应得到3.81 g(即0.015 mol) I2可知反应的Cr2O72—的物质的量为0.005 mol,则2.83 g X中含有Cr3+的物质的量为0.01 mol;由X与BaCl2的反应可知2.83 g X中含有SO42—的物质的量为0.02 mol;根据电荷守恒可知K+的物质的量为0.01 mol,可知X的化学式为K2SO4·Cr2(SO4)3,A项正确

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案
相关题目

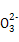 数小于NA
数小于NA