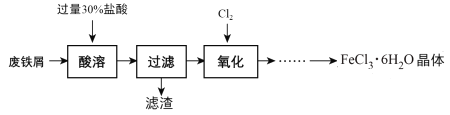
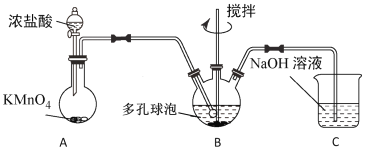
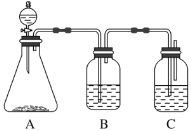
题目内容
【题目】将A与B的混合物15mol放人容积为2L的密闭容器里,在一定条件下发生反应:2A(g)+3B(g)![]() C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
A.0.15mol·L-1·min-1 B.0.3mol·L-1·min-1
C.0.45mol·L-1·min-1 D.0.6mol·L-1·min-1
【答案】A
【解析】
试题分析:2A(g)+3B(g)![]() C(g)+2D(g),生成3molB物质的量减少2,消耗amolB物质的量减少2a/3,压强之比等于物质的量之比,即15/(15-2a/3)=5:4,解得a=4.5mol,v(B)=4.5/(2×15)mol/(L·min)=0.15 mol/(L·min),故选项A正确。
C(g)+2D(g),生成3molB物质的量减少2,消耗amolB物质的量减少2a/3,压强之比等于物质的量之比,即15/(15-2a/3)=5:4,解得a=4.5mol,v(B)=4.5/(2×15)mol/(L·min)=0.15 mol/(L·min),故选项A正确。

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
【题目】已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
现有两个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molA和1molB,在Ⅱ中充入1molC和1 molD,800℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中的压强相等B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中C的体积分数比容器Ⅱ中的小D.容器Ⅰ中A的浓度比容器Ⅱ中的小