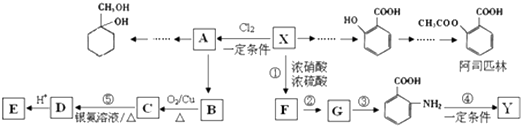
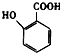
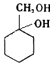
题目内容
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少? 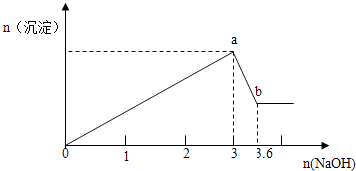
【答案】解:设n(Al3+)=n(Al(OH)3)=x,则由Al(OH)3+OH﹣═AlO2﹣+2H2O
11
x (3.6﹣3)mol
x=(3.6﹣3)mol=0.6mol,
设n(Fe3+)=y,则
Al3++3OH﹣═Al(OH)3↓
0.6mol1.8mol 0.6mol
Fe3++3OH﹣═Fe(OH)3↓
1 3
y(3﹣1.8)mol,![]() =
= ![]()
解得y=0.4mol,
c(FeCl3)= ![]() =4mol/L,
=4mol/L,
c(AlCl3)= ![]() =6mol/L,
=6mol/L,
答:FeCl3、AlCl3的物质的量浓度分别为4mol/L、6mol/L.
【解析】发生的反应有Fe3++3OH﹣═Fe(OH)3↓、Al3++3OH﹣═Al(OH)3↓、Al(OH)3+OH﹣═AlO2﹣+2H2O,结合图中消耗的NaOH的物质的量来计算即可.

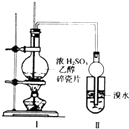
【题目】已知CaSO4受热分解,由于受热温度不同,气体成分也不同.气体成分可能为SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式.
(1)[提出猜想]Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有二种;(填分子式)
(2)Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.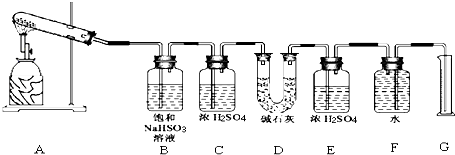
[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
①若实验结束时,G中量筒没有收集到水,则证明猜想正确.(填Ⅰ或Ⅱ或Ⅲ)
②若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由: .
③该实验设计中,容易给测定带来较大误差的因素有 .
(写出一种即可)
④经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
实验小组 | 称取CaSO4 | 装置D增加 | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
一 | 4.08 | 2.56 | 224 |
二 | 5.44 | 2.56 | 448 |
请通过计算,推断第二组同学得出的CaSO4分解的化学反应方程式:
第二组: .