题目内容
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述中正确的有

①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
A. 2个 B. 3个 C. 4个 D. 5个
【答案】A
【解析】
①其饱和溶液中阴阳离子浓度相等,a、c两点阴阳离子浓度不相等,故①错误;
②Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故②错误;
③根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,故③正确;
④d点为不饱和状态,钙离子浓度较小,如加入适量CaCl2固体,钙离子浓度增大,此时硫酸根离子浓度不变,则可以变到c点,故④正确;
⑤d为不饱和溶液,蒸发时硫酸根的浓度会增大,故⑤错误;
⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)=c(SO42-)=3×10-3mol/L,故⑥错误;
⑦CaSO4饱和溶液c(Ca2+)=c(SO42-)=3×10-3mol/L,开始不在a点,加入400mL 0.01mol/LNa2SO4溶液后,c(Ca2+)=0.6×10-3mol/L,c(SO42-)=8.6×10-3mol/L,Qc<Ksp,没有沉淀生成,此时为不饱和溶液,故⑦错误。
综合以上分析③④正确,正确的有2个。
故选A。

 阅读快车系列答案
阅读快车系列答案【题目】由下列实验现象一定能得出相应结论的是
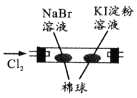
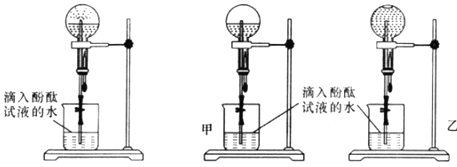
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D