题目内容
【题目】硼、磷元素在化学中有很重要的地位,硼、磷及其化合物广泛应用于开发新型储氢材料、超导材料、富燃料材料、复合材料等高新材料领域。回答下列问题。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有___个。
②LiBH4由Li+和BH4-构成,BH4-呈正四面体构型。LiBH4中不存在的作用力有___(填标号)
A.离子键 B.共价键 C.金属键 D.配位键
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为____,写出一种与氨硼烷互为等电子体的分子___(填化学式)。
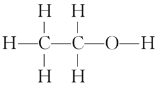
(3)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图]。
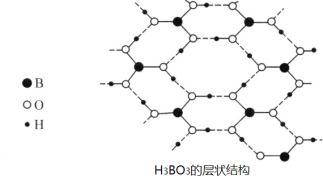
读图分析1mol H3BO3的晶体中有___mol氢键。
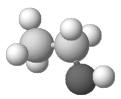
(4)四(三苯基膦)钯分子结构如图:
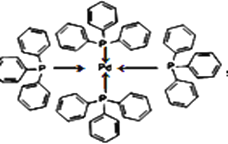
P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为___;判断该物质在水中___(填写“易溶”或者“难溶”),并加以解释____。
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
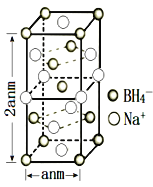
①该晶体中Na+的配位数为___。
②已知硼氢化钠晶体的密度为ρg/cm3,NA代表阿伏伽德罗常数的值,则a=___(用含ρ、NA的最简式子表示)
【答案】1 C 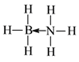 C2H6 3 sp3 难溶 水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶 8
C2H6 3 sp3 难溶 水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶 8 ![]() ×107
×107
【解析】
(1)①基态Ti原子价电子排布式为3d24s2,Ti原子失去4s能级上2个电子、3d能级上1个电子生成基态Ti3+,所以基态Ti3+的未成对电子数有1个,
故答案为:1;
②LiBH4中阴阳离子之间存在离子键,BH原子之间存在4个共价键、其中1个是配位键,所以该物质中含有离子键和共价键、配位键,所以不存在金属键,
故答案为:C;
(2)氨硼烷(NH3BH3)分子中存在配位键,B原子和N原子之间存在配位键,其结构式为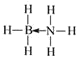 ;氨硼烷互为等电子体的分子中含有8个原子、价电子数是14,与其互为等电子体的分子有C2H6,
;氨硼烷互为等电子体的分子中含有8个原子、价电子数是14,与其互为等电子体的分子有C2H6,
故答案为: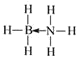 ;C2H6;
;C2H6;
(3)硼酸分子中B最外层有3个电子,1个H3BO3分子能形成3个氢键,1molH3BO3的晶体中有3mol氢键,
故答案为:3;
(4)四(三苯基膦)钯分子中P原子以正四面体的形态围绕在钯原子中心上,钯原子价层电子对个数是4,根据价层电子对判断钯原子的杂化轨道类型为sp3;非极性分子的溶质易溶于非极性分子的溶剂,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶,
故答案为:sp3;难溶于水;水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶;
(5)①该晶体中Na+的配位数=2×8÷2=8,
故答案为:8;
②该晶胞中钠离子个数=![]() 、BH4个数=
、BH4个数=![]() ,晶胞体积=
,晶胞体积=![]() ,晶胞密度=
,晶胞密度=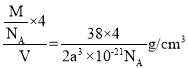 =ρg/cm3,则
=ρg/cm3,则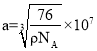 ,
,
故答案为: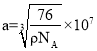 。
。

【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。