题目内容
11.下面有关晶体的叙述中,正确的是( )| A. | 在氯化钠晶体中每个Na+(或Cl-)周围都紧邻8个Cl-(Na+) | |
| B. | 原子晶体中只存在共价键 | |
| C. | 离子晶体和分子晶体在熔化时,化学键都被破坏 | |
| D. | 熔融状态下能导电的晶体一定是金属晶体 |
分析 A、氯化钠晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(Na+).
B、原子晶体指的是相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体;
C、分子晶体在熔化时破坏分子间作用力;
D、离子晶体在熔融状态下能够导电.
解答 解:A、氯化钠晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(Na+),而非8个,故A错误;
B、原子晶体指的是相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体,故原子晶体中只存在共价键,故B正确;
C、离子晶体是通过离子键将阴、阳离子结合在一起的,所以熔化时,离子键被破坏,分子晶体是通过范德华力结合时,熔化时化学键不受影响,故C错误;
D、金属晶体、离子晶体在熔融状态下都能够导电,所以熔融状态下导电的晶体不一定是金属晶体,故D错误.
故选B.
点评 考查晶胞结构、晶体微粒间作用、晶体性质、化学键等,难度不大,注意分子间不存在化学键.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 1.00molNaCl中,所有的Na+的最外层电子总数8×6.02×1023 | |
| C. | 欲配制1L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
2.互为同分异构体的物质不可能( )
| A. | 具有相同的相对分子质量 | B. | 具有相同的分子式 | ||
| C. | 具有相同的组成元素 | D. | 具有相同的熔、沸点 |
19.下列情况会对人体健康造成较大危害的是( )
| A. | 自来水中通入少量Cl2进行消毒杀菌 | |
| B. | 用小苏打(NaHCO3)发酵面团制作馒头 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| D. | 用SO2漂白食品 |
6.下列各种说法中正确的是( )
| A. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| B. | 凡是能起银镜反应的物质一定是醛 | |
| C. | 在酯化反应中,羧酸脱去羧基中的氢原子,醇脱去羟基生成水和酯 | |
| D. | 苯酚有弱酸性,因此它是一种羧酸 |
16.下列化学用语表示正确的是( )
| A. | CS2的比例模型: | |
| B. | H2O2的电子式: | |
| C. | 氯离子(Cl-)的结构示意图: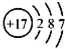 | |
| D. | 基态镁原子的电子排布图:1s22s22p63s2 |
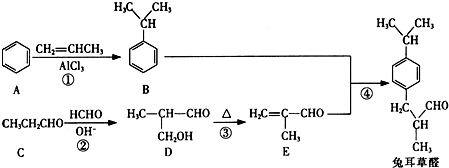
 (填结构简式)
(填结构简式)
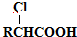 ,以物质C为原料制备聚乳酸(
,以物质C为原料制备聚乳酸(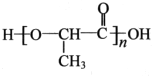 ),可通过四步反应制得,按反应顺序,这四步的反应类型依次是:氧化反应、取代反应、水解反应、缩聚反应.
),可通过四步反应制得,按反应顺序,这四步的反应类型依次是:氧化反应、取代反应、水解反应、缩聚反应. .
.