题目内容
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
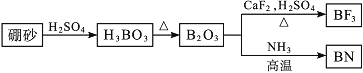
请回答下列问题:
(1)B和N相比,电负性较大的是___,BN中B元素的化合价为___;
(2)在BF3分子中,F—B—F的键角是___;BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___,层间作用力为___,六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为___,其结构与石墨相似却不导电,原因是___。
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有___个氮原子、___个硼原子,立方氮化硼的密度是___g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
【答案】N +3 120° 正四面体 极性共价键 分子间作用力 平面三角形 层状结构中没有自由移动的电子 4 4 
【解析】
(1)同一周期元素,电负性随着原子序数增大而增大,所以电负性N>B;化合物中各元素化合价的代数和为0,该化合物中N元素化合价为3价,则B元素化合价为+3价,
故答案为:N;+3;
(2)BF3分子中B原子价层电子对个数是3且不含孤电子对,所以为平面正三角形结构,则FBF的键角是120°;![]() 中B原子价层电子对个数是4且不含孤电子对,所以
中B原子价层电子对个数是4且不含孤电子对,所以![]() 是正四面体结构,
是正四面体结构,
故答案为:120°;正四面体;
(3)不同非金属元素之间易形成极性键,所以BN原子之间存在极性键共价键;石墨层间作用力为分子间作用力,所以层之间存在分子间作用力;六方相氮化硼晶体层内一个硼原子与3个氮原子形成平面三角形结构,最外层电子全部成键,没有自由移动的电子存在,故不能导电,
故答案为:极性共价键;分子间作用力;平面三角形;层状结构中没有自由移动的电子;
(4)该晶胞中如果B原子位于顶点和面心上,则N原子位于晶胞内部,且一个顶点和三个面心上B原子连接一个N原子,所以该晶胞中B原子个数=![]() =4,N原子个数也为4;该晶胞边长=361.5pm=361.5×1010cm,体积=(361.5×1010cm)3,密度=
=4,N原子个数也为4;该晶胞边长=361.5pm=361.5×1010cm,体积=(361.5×1010cm)3,密度=  =
=  g/cm3=
g/cm3= g/cm3,
g/cm3,
故答案为:4;4; 。
。



