��Ŀ����
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����ԭ��������XYTZ��������
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
X | �����������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
T | �����������ǵ��Ӳ�����2�� |
Z | Ԫ�����������+7�� |
��1������Ԫ��ԭ�Ӱ뾶�ɴ�С��˳���ǣ�дԪ�ط��ţ� ��
��2��Ԫ��Y����Ԫ���γɵ�һ������YH4+ �� д�������ĵ���ʽ����Ԫ�ط��ű�ʾ����
��3��TԪ�صļ������ӵĽṹʾ��ͼ�� ��
��4��֤�������ӵĻ�ԭ�Ա�Z��ǿ�����ӷ���ʽ�� ��
��5��Ԫ��Z�ĵ���������������Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��6����9g����X������������ȼ�գ���������ͨ��1L 1molL��1NaOH��Һ�У���ȫ���պ���Һ�ڼ�ѹ�������������ɣ��õ������ᾧˮ�Ĺ�������Ϊg��
���𰸡�
��1��S��Cl��C��N
��2��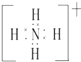
��3��
��4��Cl2+S2��=S+2Cl��
��5��Cl2+2NaOH=NaCl+NaClO+H2O
��6��68.5
���������⣺X��ԭ�������������Ǵ����ĵ�������2�����������������ܳ���8��������������K�㣬�������L�㣬L���ϵ�������4����Rԭ�Ӻ��������=2+4=6�����Ը�Ԫ����CԪ�أ�Y������˫ԭ�ӷ��ӣ������⻯��ˮ��Һ�Լ��ԣ���֪Y��NԪ�أ�TԪ��ԭ�ӵ������������ǵ��Ӳ���2����Ԫ�أ���ԭ��������ϵ��֪TΪSԪ�أ�Z���������Ϊ+7�ۣ�ӦΪClԪ��.
��1.��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶S��Cl��C��N�����Դ��ǣ�S��Cl��C��N��
��2.��YH4+Ϊ笠����ӣ�����ʽΪ 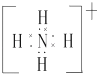 �����Դ��ǣ�
�����Դ��ǣ�  ��
��
��3.�������Ӻ�����3�����Ӳ㣬����������Ϊ8���ṹʾ��ͼΪ 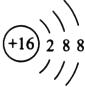 ��
��
���Դ��ǣ�  ��
��
��4.���ǽ����ķǽ�����Խǿ����������ӵĻ�ԭ��Խ�����䵥�ʵ�������Խǿ���������ܻ�ԭ�������������ӣ����������ӻ�ԭ�Դ��������ӣ����ӷ���ʽΪCl2+S2��=S+2Cl�����Դ��ǣ�Cl2+S2��=S+2Cl����
��5.������������������Һ��Ӧ�����Ȼ��ƺʹ������ƣ�����ʽΪCl2+2NaOH=NaCl+NaClO+H2O�����Դ��ǣ�Cl2+2NaOH=NaCl+NaClO+H2O��
��6.��n��C��= ![]() =0.75mol��n��NaOH��=1L��1molL��1=1mol�����߷���3CO2+4NaOH=Na2CO3+2NaHCO3+2H2O���ɷ���ʽ��֪����0.25molNa2CO3��0.5molNaHCO3 �� ����Ϊ0.25mol��106g/mol+0.5mol��84g/mol=68.5g�����Դ��ǣ�68.5��
=0.75mol��n��NaOH��=1L��1molL��1=1mol�����߷���3CO2+4NaOH=Na2CO3+2NaHCO3+2H2O���ɷ���ʽ��֪����0.25molNa2CO3��0.5molNaHCO3 �� ����Ϊ0.25mol��106g/mol+0.5mol��84g/mol=68.5g�����Դ��ǣ�68.5��

 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�����Ŀ��������Ʒ����Ҫ�ɷֲ���ȷ����
A | B | C | D | |
��Ʒ | ˮ���� | ��84������Һ | С�մ� | ���ά |
��Ҫ�ɷ� | Na2SiO3 | NaClO | NaHCO3 | Si |
A. A B. B C. C D. D
����Ŀ��ij��ѧ��ȤС���ͬѧͨ���������ϣ�����˲����һЩ��Ϣ���������±���
�ṹ��ʽ | HOOC-OOH |
�ܽ��� | ������ˮ���������Ҵ� |
���� | ��Լ��157������(175�����Ϸ����ֽ�) |
��ѧ���� | H2C2O4+Ca(OH)2=CaC2O4��+2H2O |
HOOC-COOH | |
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2��+8H2O |
��1������ͬѧ��ͨ��ʵ����֤�������ȷֽ�����е�CO2��CO(װ�÷���������Ҫ�������Լ���ѡ)��

����д���п��ڡ�
���� | A | B | C |
�����Լ� | ________ | ________ | NaOH��Һ |
�ڼ�������CO��ʵ�鷽����ʵ������__________________��
��2��ʵ���ҳ��ò����ƲⶨKMnO4��Һ��Ũ�ȡ�
��ȷ��ȡ2.680g�����ƣ�����ϡ�����ˮ�Ƴ�100.0 mL��Һ��ÿ��ȡ20.00mL��Һ����ƿ�У�������KMnO4��Һ����_______________(������ʽ��������ʽ��)�ζ����н��еζ����ظ������ζ��������Σ�ʵ��������±���ʾ������KMnO4��Һ�����ʵ���Ũ��Ϊ____________��
�ζ�ǰ��Ϊ | ��һ���յ� | �ڶ����յ� | �������յ� | |
�ζ���Һ��̶� | 0.00 mL | 20.02mL | 21.00mL | 19.98mL |
�ڽ�����KMnO4��Һ��H2C2O4��Һ��Ϻ��ֿ�ʼʱ��Һ��ɫ�����ԣ������ú�Ѹ����ɫ����Ը�ʵ������ijͬѧ��ΪKMnO4��Һ��H2C2O4��Һ�ķ�Ӧ�Ƿ��ȷ�Ӧ��������Һ�¶����ߣ���Ӧ���ʼӿ졣����뻹�п�����_____________��Ӱ�졣����ʵ��֤����IJ��룬��KMnO4��Һ��H2C2O4��Һ��ϡ�����⣬����Ҫѡ��ĺ����Լ���__________________��
