题目内容
【题目】光气(COCl2)常作有机合成、农药、药物、燃料及其他化工制品的中间体。
(1)COCl2结构与甲醛相似,写出COCl2电子式_____;解释COCl2的沸点比甲醛高的原因是_____。
(2)密闭容器中吸热反应COCl2(g)![]() Cl2(g)+CO(g)达到平衡后,改变一个条件,各物质的浓度变化如图所示(10~14min时有一物质浓度变化未标出)。
Cl2(g)+CO(g)达到平衡后,改变一个条件,各物质的浓度变化如图所示(10~14min时有一物质浓度变化未标出)。
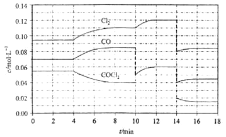
①说明该反应已达到平衡状态的是_____。
a.C(COCl2)=C(Cl2)
b.正(COCl2)=逆(CO)
c.容器内温度保持不变
d.容器内气体密度保持不变
②4~10min平均反应速率v(COCl2)为_____;10min时改变的反应条件是_____。
③0~4min、8~10min和16~18min三个平衡常数依次为K1、K2、K3,比较其大小____;说明理由____。
【答案】![]() 均为分子晶体,COCl2式量较大,范德华力较强,沸点较高 bc 0.0025mol/(L·min) 分离出CO K1<K2=K3 4min时改变条件为升温,吸热反应升温K变大
均为分子晶体,COCl2式量较大,范德华力较强,沸点较高 bc 0.0025mol/(L·min) 分离出CO K1<K2=K3 4min时改变条件为升温,吸热反应升温K变大
【解析】
(1)甲醛的结构式是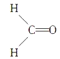 ;COCl2的相对分子质量大于甲醛;
;COCl2的相对分子质量大于甲醛;
(2)①根据平衡标志分析;
②根据![]() 计算4~10min平均反应速率v(COCl2);由图象可知10min时CO的浓度突然减小,后逐渐增大,10min时Cl2的浓度逐渐增大;
计算4~10min平均反应速率v(COCl2);由图象可知10min时CO的浓度突然减小,后逐渐增大,10min时Cl2的浓度逐渐增大;
③根据图象可知,4min时改变的条件是升高温度、14min时,各物质浓度均减小,改变的条件是减小压强。
(1)甲醛的结构式是 ,COCl2结构与甲醛相似,COCl2电子式是
,COCl2结构与甲醛相似,COCl2电子式是![]() ;甲醛、COCl2均为分子晶体,COCl2式量较大,范德华力较强,沸点较高;
;甲醛、COCl2均为分子晶体,COCl2式量较大,范德华力较强,沸点较高;
(2)①a.c(COCl2)=c(Cl2)时,浓度不一定不再改变,反应不一定平衡,故不选a;
b.反应达到平衡状态时,正逆反应速率比等于系数比, 正(COCl2)=逆(CO),一定平衡,故选b;
c.正反应吸热,密闭容器内温度是变量,容器内温度保持不变,反应一定平衡,故选c;
d.气体质量不变、容器体积不变,根据![]() ,密度是恒量,容器内气体密度保持不变,不一定平衡,故不选d;
,密度是恒量,容器内气体密度保持不变,不一定平衡,故不选d;
选bc;
②根据图象,4~10min内COCl2浓度变化是0.055mol/L-0.04mol/L=0.015mol/L, ![]() 0.0025mol/(L·min);由图象可知10min时CO的浓度突然减小,后逐渐增大,10min时Cl2的浓度逐渐增大,可知10min时改变的条件是分离出CO,平衡正向移动,氯气浓度增大;
0.0025mol/(L·min);由图象可知10min时CO的浓度突然减小,后逐渐增大,10min时Cl2的浓度逐渐增大,可知10min时改变的条件是分离出CO,平衡正向移动,氯气浓度增大;
③根据图象可知,4min时改变的条件是升高温度,正反应吸热,升高温度平衡正向移动,平衡常数增大,所以K1<K2,14min时改变的条件是减小压强,平衡常数只与温度有关,所以K2=K3,故K1、K2、K3的大小关系是K1<K2=K3;

 天天向上口算本系列答案
天天向上口算本系列答案