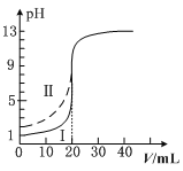
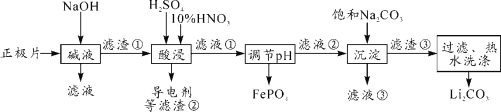
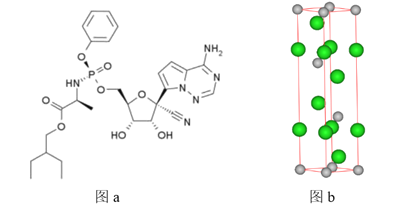
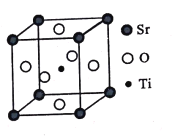
题目内容
【题目】氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
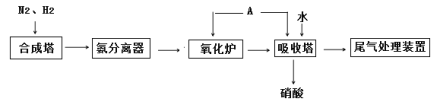
(1)写出合成塔中发生反应的化学方程式____________________,
(2)写出氧化炉中发生反应的化学方程式____________________
(3)A物质为______,向吸收塔中通入A的作用__________
(4)工业生产中为了盛装大量浓硝酸,可选择___作为罐体材料
A. 铜 B.铂 C.铝 D.镁
(5)为避免尾气氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。前者使用具有碱性的Na2CO3溶液等吸收尾气,后者在催化下使用NH3或其他物质将氮氧化物还原为N2。请以尾气中的NO2处理为例,写出相关反应的化学方程式____________、_____________。
【答案】N2+3H2 ![]() 2NH3 4NH3+5O2
2NH3 4NH3+5O2![]() 4NO+6H2O 空气(氧气) 促进NO转化为NO2 C O2+4NO2+2Na2CO3=2CO2+4NaNO3 (或 2NO2+Na2CO3=NaNO3+NaNO2+CO2)
4NO+6H2O 空气(氧气) 促进NO转化为NO2 C O2+4NO2+2Na2CO3=2CO2+4NaNO3 (或 2NO2+Na2CO3=NaNO3+NaNO2+CO2) ![]()
【解析】
氮气和氢气进入合成塔催化剂高温高压反应生成氨气,进入氨分离器,从氨分离器中又回到合成塔中的物质是N2和H2,氨气进入氧化炉中发生反应为氨气的催化氧化,进入吸收塔,通入空气使NO2和NO全部转化为HNO3,得到尾气中的少量NO、NO2可以用NH3来处理,据此分析解答。
(1) 氮气和氢气进入合成塔催化剂高温高压反应生成氨气,合成塔中发生反应的化学方程式:N2+3H2 ![]() 2NH3;
2NH3;
(2) 氨气进入氧化炉中发生反应为氨气的催化氧化,反应中N元素化合价由NH3中3价升高为NO中+2价,共升高5价,O元素由O2中0价降低为2价,共降低4价,化合价升降最小公倍数为20,故NH3系数为4,故O2系数为5,利用元素守恒平衡可知NO系数为4,H2O的系数为6,化学方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气发生反应2NO+O2=2NO2;4NO+3O2+2H2O=4HNO3;4NO2+O2+2H2O=4HNO3,所以通入空气作用为使NO2和NO全部转化为HNO3,A物质为氧气或空气,向吸收塔中通入A的作用是促进NO转化为NO2;
(4)铝与浓硝酸会发生钝化,工业生产中为了盛装大量浓硝酸,可选择铝作为罐体材料,浓硝酸有强氧化性,铜、铂、镁等大多数金属都会与浓硝酸反应,所以不能使用;
(5) 根据题中信息,使用具有碱性的Na2CO3溶液等吸收尾气,化学方程式为:O2+4NO2+2Na2CO3=2CO2+4NaNO3 (或 2NO2+Na2CO3=NaNO3+NaNO2+CO2);NO2和NH3反应生成氮气和水,反应的化学方程式为:![]() 。
。

【题目】苯胺(![]() )是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
)是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
已知:①![]() 与NH3相似,与盐酸反应生成
与NH3相似,与盐酸反应生成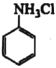 (易溶于水的盐)。
(易溶于水的盐)。
②用硝基苯制取苯胺的反应为:2![]() +3Sn+12HCl
+3Sn+12HCl![]() 2
2![]() +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/g·cm-3 |
苯胺 | 93 | 6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
硝基苯 | 123 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
乙醚 | 74 | 116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.制备苯胺
图1所示装置中加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,向三颈烧瓶中滴入一定量50%NaOH溶液,至溶液呈碱性。
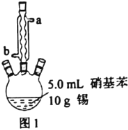
(1)滴加适量NaOH溶液的目的是___,写出主要反应的离子方程式___。
ⅰ.取出图l所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气。用“水蒸气蒸馏”的方法把B中苯胺逐渐吹出,在烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液甲。
ⅱ.向所得水溶液甲中加入氯化钠固体至饱和,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺1.86g。
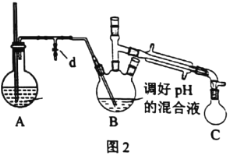
(2)装置A中玻璃管的作用是__。
(3)在苯胺吹出完毕后,应进行的操作是先__,再___。
(4)该实验中苯胺的产率为___(保留三位有效数字)。
(5)欲在不加热条件下除去苯胺中少量的硝基苯杂质,简述实验方案___。