题目内容
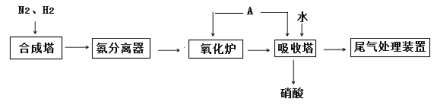
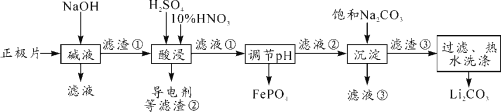
【题目】2019年诺贝尔化学奖授予对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
(1)“碱溶”时Al箔溶解过程中,氧化剂是______________。
(2)“酸浸”时生成NO的离子方程式是_________。(其他杂质不与HNO3反应)
(3)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率为90%,则加入饱Na2CO3 溶液中c(Na2CO3)=______ mol·L-1。[Ksp(Li2CO3)=1.6×10-3]
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的_____(填“正极”或“负极”);放电时,正极反应式为_______。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的_____(填“正极”或“负极”);放电时,正极反应式为_______。
(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.20g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.020mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是_________。
②磷酸亚铁锂电池中铁的含量为________%。
【答案】H2O 3LiFePO4+NO3-+4H+=3Li++NO↑+3PO43-+2H2O+3Fe3+ 1.88 负极 Li1-xFePO4+xLi++xe-=LiFePO4 将溶液中过量Sn2+转化为稳定的SnCl62-,防止其干扰Fe2+的测定 22.4
【解析】
分析流程图,磷酸亚铁锂电池正极片碱溶时,Al转化为NaAlO2,过滤后,滤渣中含有磷酸亚铁锂,向其中加入硫酸和硝酸进行酸浸,得到含Li+、Fe3+、H+、SO42-、NO3-和PO43-的滤液,调节溶液的pH,使得Fe3+以FePO4的形式除去,过滤后得到含Li+、H+、SO42-和NO3-的滤液,加入饱和Na2CO3溶液,将Li+转化为Li2CO3,通过过滤、热水洗涤等操作得到最终产物。据此进行分析。
(1)“碱溶”时Al箔溶解过程中发生的反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应实质为2Al+6H2O=2Al(OH)3+3H2↑,Al(OH)3+NaOH=NaAlO2+2H2O,根据氧化还原原理,化合价降低是H2O中的H,因此氧化剂为:H2O;
(2)酸浸时,磷酸亚铁锂电池正极片上的Fe2+与HNO3反应,生成Fe3+和NO,反应的离子反应方程式为:3LiFePO4+NO3-+4H+=3Li++NO↑+3PO43-+2H2O+3Fe3+;
(3)滤液②中c(Li+)=4mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率为90%,则Li+的转化浓度为![]() ,由关系式:2Li+~CO32-可知,CO32-的转化浓度为
,由关系式:2Li+~CO32-可知,CO32-的转化浓度为![]() 。滤液②中加入等体积的Na2CO3溶液后,c(Li+)=
。滤液②中加入等体积的Na2CO3溶液后,c(Li+)=![]() ,由碳酸锂溶度积Ksp(Li2CO3)=
,由碳酸锂溶度积Ksp(Li2CO3)=![]() ,可得c(CO32-)=
,可得c(CO32-)=![]() ,则原饱和Na2CO3溶液中c(Na2CO3)=
,则原饱和Na2CO3溶液中c(Na2CO3)=![]() ;
;
(4)根据电池总反应:LiFePO4+6C![]() Li1-xFePO4+LixC6,放点过程中,C6x-中的C的化合价升高生成C单质,失去电子,作负极,可知,LixC6极为原电池的负极,充电时为阴极,发生还原反应,则应与电源的负极相连。放电时,原电池的正极发生还原反应,则反应方程式为:Li1-xFePO4+xLi++xe-=LiFePO4;
Li1-xFePO4+LixC6,放点过程中,C6x-中的C的化合价升高生成C单质,失去电子,作负极,可知,LixC6极为原电池的负极,充电时为阴极,发生还原反应,则应与电源的负极相连。放电时,原电池的正极发生还原反应,则反应方程式为:Li1-xFePO4+xLi++xe-=LiFePO4;
(5)①根据题给信息,SnCl2溶液稍过量,为了排除溶液中过量Sn2+干扰Fe2+的测定,故用HgCl2饱和溶液将其转化为稳定的SnCl62-。
②由题给已知条件,可得关系式:6Fe3+~Cr2O72-,则有:
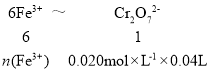
解得:![]() ;则磷酸亚铁锂电池中铁的含量为
;则磷酸亚铁锂电池中铁的含量为![]() 。
。