题目内容
【题目】已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
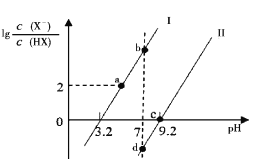
A.直线I对应的是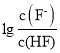
B.I中a点到b点的过程中水的电离程度逐渐增大
C.c点溶液中:![]()
![]()
D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+)
【答案】D
【解析】
A.纵坐标为0时即![]() =1,此时Ka=
=1,此时Ka=![]() =c(H+),因此直线I对应的Ka=10-3.2, 直线II对应的Ka= 10-9.2, 由于HF酸性强于HCN,因此直线I对应
=c(H+),因此直线I对应的Ka=10-3.2, 直线II对应的Ka= 10-9.2, 由于HF酸性强于HCN,因此直线I对应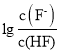 ,A正确;
,A正确;
B.a点到b点的过程中HF浓度逐渐减小,NaF浓度逐渐增大,因此水的电离程度逐渐增大,B正确;
C.Ka(HCN)= 10-9.2 ,NaCN的水解常数Kh(NaCN)=10-4.8>Ka(HCN),因此等浓度的HCN和NaCN的混合溶液中c(CN-)<c(HCN),c点是HCN和NaCN的混合溶液且c(CN-)=c(HCN),因此c(NaCN)>c(HCN),即有c(Na+)>c(CN-);由于OH-、H+来自水的电离,浓度比较小且此时溶液的pH为9.2,C点溶液中存在:c(Na+)>c(CN-)=c(HCN) >c(OH-)>c(H+),C正确;
D.由于HF酸性强于HCN,要使溶液均显中性,HF溶液中要加入较多的NaOH,因此cb(Na+)>cd(Na+),D错误;
答案选D。

【题目】四种短周期元素的性质或结构信息如下表所示,请回答下列问题。
元素 | A | B | C | D |
性质或结构信息 | 单质在常温下为固体,难溶于水,易溶于CS2。能形成两种二元含氧酸 | 原子的M层有1个未成对的p电子,核外p电子总数大于7 | 单质曾被称为“银色的金子”与锂形成的合金常用于制造航天飞行器。单质能溶于强酸和强碱溶液 | 原子核外电子层上s电子总数比p电子总数少2。单质和氧化物均为空间网状结构,具有很高的熔、沸点 |
(1)A原子的最外层电子排布式为_______________,D原子核外共有____________个电子。
(2)写出C的单质与强碱溶液反应的离子方程式:______________________________________________。
(3)A、B两元素的氢化物分子中键能较小的是__________________________(填分子式);分子较稳定的是__________________(填分子式)。
(4)E、D同主族,均为短周期元素。它们的最高价氧化物晶体中熔点较高的是________________。
(5)已知D的单质的晶体结构与SiC的晶体结构相似,其中C原子的杂化方式为______________。SiC与D的单质的晶体的熔、沸点高低顺序是________________。