题目内容
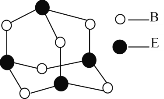
【题目】(1)某科学工作者通过![]() 射线衍射分析推测胆矾中既含有配位键,又含有氢键,其结构可能如图所示,其中配位键和氢键均用虚线表示。
射线衍射分析推测胆矾中既含有配位键,又含有氢键,其结构可能如图所示,其中配位键和氢键均用虚线表示。

①写出基态Cu原子的核外电子排布式:__。
②写出图中水合铜离子的结构简式(必须将配位键表示出来):__。
(2)很多不饱和有机物在Ni的催化作用下可以与H2发生加成反应,如①CH2=CH2、②CH![]() CH、③
CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有__(填序号),推测HCHO分子的立体构型为__形。
、④HCHO等,其中碳原子采取sp2杂化的分子有__(填序号),推测HCHO分子的立体构型为__形。
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 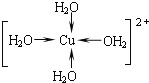 ①③④ 平面三角
①③④ 平面三角
【解析】
(1)①铜是29号元素,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;②CuSO45H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4,据此书写水合铜离子的结构简式;
(2)根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数;根据杂化轨道方式及杂化轨道成键情况判断HCHO立体结构。
①铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
②CuSO45H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4,水合铜离子的结构简式为 ,故答案为:
,故答案为: ;
;
(2)①CH2=CH2中每个碳原子成2个C-Hσ键,1个碳碳双键,双键中含有1个σ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;②CH≡CH中每个碳原子成1个C-Hσ键,1个碳碳三键,三键中含有1个σ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化;③苯中每个碳原子成1个C-Hσ键,2个C-Cσ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;④HCHO中碳原子成2个C-Hσ键,1个碳氧双键,双键中含有1个σ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;故①③④采取sp2杂化;HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,没有孤对电子对,参与成键的原子不同,所以HCHO为平面三角形,故答案为:①③④;平面三角。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案