题目内容
11.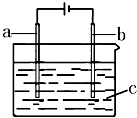 某同学按如图所示的装置(a、b是电极,c为电解质溶液)分别进行了下表列出的四组实验:
某同学按如图所示的装置(a、b是电极,c为电解质溶液)分别进行了下表列出的四组实验:| 组别 | a | b | c中的溶质 |
| 甲 | C | C | KOH |
| 乙 | Cu | Cu | NaCl |
| 丙 | Cu | Cu | CuSO4 |
| 丁 | C | C | NaCl |
| A. | 甲实验中溶液的pH要变小,两极均有气体放出 | |
| B. | 乙实验中发生反应的总反应式为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$ Cu(OH)2↓+H2↑ | |
| C. | 丙实验中c溶液的浓度不变,a极质量增大 | |
| D. | 丁实验中a极电极反应式为:2H++2e-═H2↑ |
分析 A、用隋性电解氢氧化钾溶液,实质是电解水,产生氢气和氧气,氢氧化钾浓度变大,溶液的pH变大;
B、阳极是活泼的铜失去电子,阴极是水电离产生的氢离子放电生成氢气,铜离子与氢氧根离子结合成氢氧化铜;
C、a与电源的正极相连,a是阳极,发生氧化反应,活泼金属铜失去电子,生成铜离子,a极质量减少;
D、丁实验中电极材料都是碳,所以电极本身不放电,a极是阳极,发生氧化反应,电解质溶液中的氯离子放电生成氯气.
解答 解:A、用隋性电解氢氧化钾溶液,实质是电解水,氢氧化钾浓度变大,溶液的pH变大,阳极产生氧气,阴极产生氢气,故A错误;
B、阳极是活泼的铜失去电子,阴极是水电离产生的氢离子放电生成氢气,铜离子与氢氧根离子结合成氢氧化铜,总的电极反应式为::Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$ Cu(OH)2↓+H2↑,故B正确;
C、a与电源的正极相连,a是阳极,发生氧化反应,活泼金属铜失去电子,生成铜离子,a极质量减少,故C错误;
D、丁实验中电极材料都是碳,所以电极本身不放电,a极是阳极,发生氧化反应,电解质溶液中的氯离子放电生成氯气,所以电极反应式为:2Cl--2e-═Cl2↑,故D错误;
故选B.
点评 本题考查电解原理,明确发生的电解反应及电极反应式的书写是解答本题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列有关工业生产的叙述不正确的是( )
| A. | 用海水淡化后的浓缩海水作原料提取溴 | |
| B. | 在太阳能资源相对充足的沿海地区建造海水淡化厂 | |
| C. | 利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱 | |
| D. | 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁 |
2.关于石油组成的下列叙述,正确的是( )
| A. | 石油只含碳、氢两种元素,是多种烃的混合物 | |
| B. | 石油裂解得到的汽油是纯净物 | |
| C. | 石油是液态的物质,只含液态烃 | |
| D. | 石油的大部分是液态烃,其中溶有气态烃和固态烃 |
19.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
| A. | 可以从海水中提取出铀和重水等核能开发中的重要原料 | |
| B. | 利用潮汐发电是将化学能转化为电能 | |
| C. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| D. | 海水中含有钾元素,只需通过物理变化就可以得到钾单质 |
6.下列叙述中不正确的是( )
| A. | 牛油、纤维素、蛋白质都是高分子化合物 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 棉花和人造丝的主要成分都是纤维素 | |
| D. | 浓硝酸和蛋白质发生反应可使皮肤呈黄色 |
16.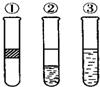 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )| A. | ①是CCl4,②是苯,③是酒精 | B. | ①是酒精,②是CCl4,③是苯 | ||
| C. | ①是苯,②是CCl4,③是酒精 | D. | ①是苯,②是酒精,③是CCl4 |
3.下列说法错误的是( )
| A. | 石油的裂化、油脂的硬化、煤的液化均属于化学变化 | |
| B. | 葡萄糖、蔗糖、麦芽糖均属于还原性糖 | |
| C. | 淀粉、纤维素均属于天然高分子化合物 | |
| D. | Al2O3、Al(OH)3、氨基酸均为两性化合物,能与酸、碱反应生成盐 |
20.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形形.
(2)某同学根据上述信息,所画的B电子排布图如图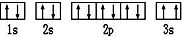 ,违背了泡利不相容泡利原理.
,违背了泡利不相容泡利原理.
(3)F位于第三周期第ⅦB族d区,其基态原子有25种运动状态.
(4)CD3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验E元素的方法是焰色反应.
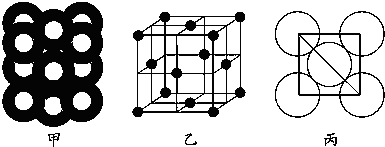
(5)若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(2)某同学根据上述信息,所画的B电子排布图如图
 ,违背了泡利不相容泡利原理.
,违背了泡利不相容泡利原理.(3)F位于第三周期第ⅦB族d区,其基态原子有25种运动状态.
(4)CD3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验E元素的方法是焰色反应.
(5)若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).

1.关于下列各组物质说法正确的是( )
| A. | 苯和甲苯不互为同系物 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. | 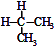 与 与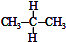 互为同分异构体 互为同分异构体 | D. | 异丁烷与2-甲基丙烷互为同种物质 |