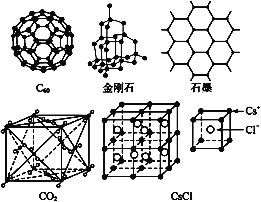
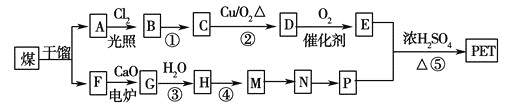
题目内容
【题目】氧化铟(In2O3)用作光谱纯试剂、光电显示半导体薄膜和电子元件的材料等,铟产业被称为“信息时代的朝阳产业”。利用水铟矿[主要成分为In(OH)3]制备In2O3的工艺流程如下:
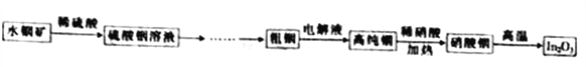
已知:常温下Ksp[In(OH)3]=1.41×10-33。
回答下列问题:
(1)In2O3中In的化合价为_________________。
(2)用硫酸酸浸水铟矿时发生反应的离子方程式为(杂质不参与反应)_________________。
(3)用硫酸从水铟矿中提取铟时,酸度与浸出率关系如图,则适宜硫酸的物质的量浓度为______。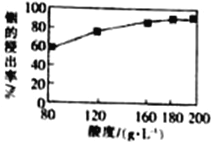
(4)高纯铟与稀硝酸反应的离子方程式为_________________。
(5)硝酸铟高温下生成氧化铟的同时又红棕色气体产生。写出该反应的化学方程式:________。
(6)粗铟电解精炼为高纯铟时、阳极的电极反应为_________________。
(7)水铟矿溶于硫酸中得到c(In3+)=1.41mol·L-1,要使In3+不产生沉淀,计算此时溶液的pH(写出必要的计算式)___________。
【答案】 +3 In(OH)3+3H+=In3++3H2O 1.84mol·L-1 In+NO3-+4H+![]() In3++NO↑+2H2O 4In(NO3)3
In3++NO↑+2H2O 4In(NO3)3![]() 2In2O3+12NO2↑+3O2↑ In-3e-=In3+ c(In3+)·c3(OH-)=1.41×10-33,c(OH-)=10-11,得pH=3
2In2O3+12NO2↑+3O2↑ In-3e-=In3+ c(In3+)·c3(OH-)=1.41×10-33,c(OH-)=10-11,得pH=3
【解析】(1)根据元素化合价代数和为零,In2O3中In的化合价为+3。
(2)水铟矿[主要成分为In(OH)3],用硫酸酸浸水铟矿时发生反应的离子方程式为:In(OH)3+3H+=In3++3H2O
(3)用硫酸从水铟矿中提取铟时,酸度与浸出率关系如图,可知当酸度为180g/L时,提取铟的浸出率很高,则适宜硫酸的物质的量浓度为180g/L![]() 98mol/L=1.84mol/L.所以本题答案:1.84mol·L-1。
98mol/L=1.84mol/L.所以本题答案:1.84mol·L-1。
(4)高纯铟与稀硝酸发生氧化还原反应,生成硝酸铟,一氧化氮和水,其离子方程式为In+NO3-+4H+![]() In3++NO↑+2H2O 。
In3++NO↑+2H2O 。
(5)硝酸铟高温下生成氧化铟的同时又红棕色气体是二氧氮产生。该反应的化学方程式:4In(NO3)3![]() 2In2O3+12NO2↑+3O2。
2In2O3+12NO2↑+3O2。
(6)粗铟电解精炼为高纯铟时、粗铟做阳极,其电极反应为In-3e-=In3+
(7)已知:常温下Ksp[In(OH)3]=1.41×10-33,水铟矿溶于硫酸中得到c(In3+)=1.41mol·L-1,要使In3+不产生沉淀,c(In3+)·c3(OH-)=1.41×10-33,c(OH-)=10-11。常温下水的离子积KW=1![]() 10-14,所以C(H+)=1
10-14,所以C(H+)=1![]() 10-3得pH=3。此时溶液的pH=3。
10-3得pH=3。此时溶液的pH=3。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案