题目内容
【题目】PET是世界上产量最大的合成纤维,其结构简式为:
![]()
现以煤的干馏产品A 与F 为原料制备PET,生产的工艺流程如图所示。
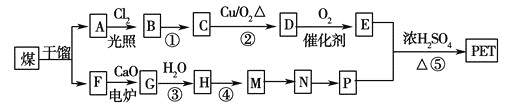
①A的分子式为C8H10,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。
②M分子里所有原子共平面。
③G 为CaC2,其与H2O 反应时元素化合价不变。
请回答下列问题:
(1)A的名称为__________。M→N 的反应类型为__________;
(2)反应①的反应条件为:__________;
(3)写出有机物A 所有一氯代物的结构简式:__________。
(4)写出下列反应的化学方程式:
①D与足量的氢氧化铜悬浊液煮佛:__________;
②反应⑤:__________。
(5)P的一种同系物X的分子式为C3H8O2 ,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2∶1∶1。则X 的结构简式为__________。
【答案】 对二甲苯 加成反应 NaOH的水溶液,加热 ![]() 或
或
![]() +4Cu(OH)2+2NaO
+4Cu(OH)2+2NaO![]()
![]() +2Cu2O↓+4H2O n
+2Cu2O↓+4H2O n![]() +nHOCH2CH2OH
+nHOCH2CH2OH![]()
![]() +(2n-1)H2O
+(2n-1)H2O ![]()
【解析】(1).能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,说明A为苯的同系物,且含有对位取代基,所以A为对二甲苯;已知M分子里所有原子共平面,M为乙烯,由于P为乙二醇,则M→N的反应类型为加成反应,生成卤代烃;
(2).B为卤代烃,反应①为卤代烃的水解,其反应条件为NaOH的水溶液,加热;
(3).Cl取代甲基中任一H原子均为同一种物质,且取代苯环上剩余任一H为另一种物质,即CH3-苯环-CH2Cl, ;
;
(4).①E含有羧基,则D含有醛基,所以此反应为醛基被氢氧化铜氧化的反应,由于氢氧化铜悬浊液的制备为硫酸铜溶液滴入氢氧化钠溶液中,所以反应方程式为:
![]() +4Cu(OH)2+2NaO
+4Cu(OH)2+2NaO![]()
![]() +2Cu2O↓+4H2O ;
+2Cu2O↓+4H2O ;
②反应⑤为缩聚反应,E为对二苯甲酸,P为乙二醇,在浓硫酸加热条件下脱水聚合,方程式为:n![]() +nHOCH2CH2OH
+nHOCH2CH2OH![]()
![]() +(2n-1)H2O;
+(2n-1)H2O;
(5). C3H8O2在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2:1:1,说明有三种不同的H原子,其中有两个羟基,为饱和烷烃的取代物,故答案为:![]() 。
。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】合成气(CO+H2) 广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气,
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5kJ的热量,请写出该反应的热化学方程式________________;
(2)在150℃时2L 的密闭容器中,将2molCH4和2mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=________。
②在该温度下,计算该反应的平衡常数K=________。
③下列选项中能表示该反应已达到平衡状态的是________。
A.V(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C(CH4)=C(CO)
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2 的体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | v甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | v乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | v丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.v乙 >v>v甲 D.P乙>P甲=P丙
(4)合成气可以制取甲醚,绿色电源“二甲醚-氧气燃料电池”工作原理如下图所示
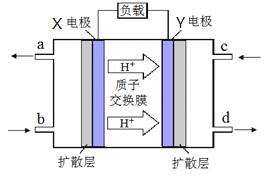
① 电极Y 上发生的反应式为__________ ;
②电池在放电过程中,电极X周围溶液的pH_______(填“增大、减小、不变”)。