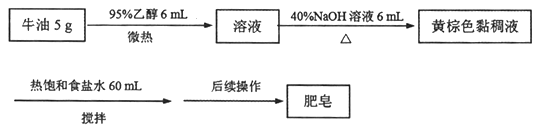
题目内容
【题目】C60、金刚石、石墨、二氧化碳和氯化铯的结构模型如图所示(石墨仅表示出其中的一层结构):
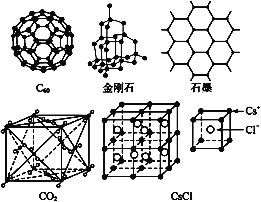
(1)C60、金刚石和石墨三者的关系是互为____。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于____(填“原子”或“分子”)晶体,C60分子中含有双键的数目是____。
(3)晶体硅的结构跟金刚石相似,1 mol晶体硅中含有硅—硅单键的数目约是____NA。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是____。
(5)观察CO2分子晶体结构的一部分,试说明每个CO2分子周围有____个与之紧邻且等距的CO2分子;该结构单元平均占有____个CO2分子。
(6)观察图形推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为___,每个Cs+周围距离相等且次近的Cs+数目为___,距离为___,每个Cs+周围距离相等且第三近的Cs+数目为____,距离为____,每个Cs+周围紧邻且等距的Cl-数目为___。
【答案】 B 分子 30 2 2 12 4 6 12 ![]() a 8
a 8 ![]() a 8
a 8
【解析】(1)C60、金刚石和石墨三者都是碳元素的不同单质,所以关系是同素异形体,答案为B。
(2)固态时,C60属于分子晶体,原因是C60是由60个碳原子组成的分子。C60分子具有足球烯的基本结构,有60个顶点(碳原子),每条棱有两个碳原子,每个碳原子延伸出3条棱,所以碳原子和棱的比例关系为2:3,所以有90条棱。每个碳原子实际应该形成4个共价键,每个共价键需要两个碳原子,所以理论上共价键是碳原子2倍,即120个。但是实际只有90条棱,说明有120-90=30个碳碳双键。
(3)每个硅原子形成4个硅硅键,每个硅硅键需要2个硅原子,所以硅硅键是硅原子数的2倍,则1mol硅晶体中含有硅硅单键的数目约是2NA个。
(4)石墨层状结构中,每个碳原子被三个正六边形共用,所以平均每个正六边形占有的碳原子数=6×![]() =2。
=2。
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以每个CO2分子周围有12个与之紧邻且等距的CO2分子。该结构为典型的立方面心晶胞,其中有![]() 个CO2分子。
个CO2分子。
(6)以大立方体体心的Cs+为例,与其距离相等且最近的Cs+位于大立方体的六个面心,所以每个Cs+周围与其距离为a的Cs+数目为6;与其距离相等且次近的Cs+位于大立方体的12个棱心,所以每个Cs+周围距离相等且次近的Cs+数目为12个,距离为小立方体的面对角线即![]() ;与其距离相等且第三近的Cs+位于大立方体的8个顶点,所以每个Cs+周围距离相等且第三近的Cs+数目为8个,距离为小立方体的体对角线即
;与其距离相等且第三近的Cs+位于大立方体的8个顶点,所以每个Cs+周围距离相等且第三近的Cs+数目为8个,距离为小立方体的体对角线即![]() ;每个Cs+周围紧邻且等距的Cl-处于8个小立方体的体心,所以有8个。
;每个Cs+周围紧邻且等距的Cl-处于8个小立方体的体心,所以有8个。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】合成气(CO+H2) 广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气,
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5kJ的热量,请写出该反应的热化学方程式________________;
(2)在150℃时2L 的密闭容器中,将2molCH4和2mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=________。
②在该温度下,计算该反应的平衡常数K=________。
③下列选项中能表示该反应已达到平衡状态的是________。
A.V(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C(CH4)=C(CO)
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2 的体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | v甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | v乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | v丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.v乙 >v>v甲 D.P乙>P甲=P丙
(4)合成气可以制取甲醚,绿色电源“二甲醚-氧气燃料电池”工作原理如下图所示
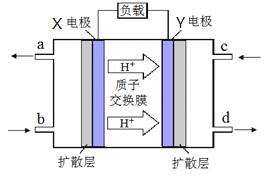
① 电极Y 上发生的反应式为__________ ;
②电池在放电过程中,电极X周围溶液的pH_______(填“增大、减小、不变”)。
【题目】有四种短周期元素,它们的结构、性质等信息如表所述:
元素 | 结构、性质等信息 |
X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质与冷水剧烈反应 |
Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒剂和杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置________;其相对分子质量最小的气态氢化物常用作______。
(2)工业上制取Y单质常用的方法是(用化学方程式表示)_________。
(3)Y离子半径比Z离子的半径________(填“大”或“小”)。
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于________(填“吸热”或“放热”)反应,写出反应的化学方程式为______________。
(5)举出实例说明M的非金属性比X强:_____________。