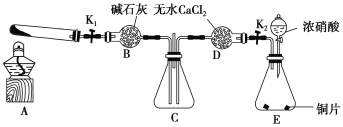
��Ŀ����
����Ŀ������������ͬһ����Ԫ�أ���������������ҪԪ�أ��䵥�ʼ���������;�㷺���ش�����������
��1����̬Pԭ�ӵĺ�������Ų�ʽΪ_____������ͬ��������Ԫ�ص�һ�������ɴ�С��˳����______________________��
��2��NH3��PH3��Һ����ԭ����______________________��
��3����Ȼ�̰���������һϵ�л�ѧ�仯��N2��NO��NO2��HNO3��NO3-���������衰���귢ׯ�ڡ���ԭ����
��N2���ӽṹ�С�����������֮��Ϊ_________����֪N![]() N�ļ���Ϊ946kJ��mol-1��Զ����N��N�ļ���(193 kJ��mol-1)��������ԭ����______________________��
N�ļ���Ϊ946kJ��mol-1��Զ����N��N�ļ���(193 kJ��mol-1)��������ԭ����______________________��
��NO3-��Nԭ�Ӳ�ȡ___________�ӻ���ʽ����ռ乹��Ϊ__________��д������һ�ֵȵ�����Ļ�ѧʽ_____________________��
����֪������HNO3>HNO2��������ؼ����������_________________��
A.����������ԭ������Խ�࣬����Խǿ
B.ͬ��Ԫ�ػ��ϼ�Խ�ߣ���Ӧ�����������Խǿ
C.HNO3�е�Ԫ�ص������Ը��ߣ���ˮ��Һ�и������H+������ǿ��HNO2
��4����Ӳ(BP)��һ�ֳ�Ӳ��ĥͿ����ϣ��侧���ṹ��ͼ��ʾ��ͼ��a���b���ԭ�������������Ϊ��0��0��0������![]() ��
�� ![]() ��
�� ![]() ������c ���ԭ���������Ϊ_______����֪�þ����ܶ�Ϊ��g��cm-3����B-P���ļ���Ϊ_____pm �������ӵ�������NA��ʾ���г�����ʽ��������
������c ���ԭ���������Ϊ_______����֪�þ����ܶ�Ϊ��g��cm-3����B-P���ļ���Ϊ_____pm �������ӵ�������NA��ʾ���г�����ʽ��������

���𰸡� 1s22s22p63s2p3 P>S>Si NH3���Ӽ������� 1:2 N![]() N�еĵ�ԭ�Ӵﵽ8���ӵ�����ȶ��ṹ sp2 ƽ�������� SO3��O4 BC ��1��
N�еĵ�ԭ�Ӵﵽ8���ӵ�����ȶ��ṹ sp2 ƽ�������� SO3��O4 BC ��1�� ![]() ��
�� ![]() ��
��  ��1010
��1010
��������(1).PΪ15��Ԫ�أ���������Ϊ3��5���ܼ�����Ϊ1s22s22p63s23p3��ͬ�����������ҵ�һ������������P��3p�ܼ�Ϊ�����״̬���Ƚ��ȶ�������P>S>Si ��
��2��NH3���Ӽ������������Ӽ���������ǿ��Ϊ��Һ�����壻
��3����N2�����γɵ��ǹ���������������һ��������������������������������֮��Ϊ1:2��
��ѧ��Խ�ȶ�������Խ��N![]() N�еĵ�ԭ�Ӵﵽ8���ӵ�����ȶ��ṹ�����������Զ��������N��N�ļ��ܡ�
N�еĵ�ԭ�Ӵﵽ8���ӵ�����ȶ��ṹ�����������Զ��������N��N�ļ��ܡ�
���������Nԭ�Ӽ۵��Ӳ����Ϊ3��,����ģ��Ϊƽ��������,û�йµ��Ӷԣ����ӻ���ʽΪsp2�ӻ����������Ϊ�ȵ����������Ϊ��SO3��O4��BF3��
��A. ͬ��Ԫ�ػ��ϼ�Խ�ߣ�����������ԭ������Խ������Խǿ��A��ƫ��ȫ������B.��A�ã�B��ȷ��C. HNO3�е�Ԫ�صõ���������ǿ���������HNO2���Ը�ǿ��C��ȷ������ѡ��BC��
��4����b������þ����߳�Ϊ1��cλ�ڲ��������ģ�����������Ϊ��1�� ![]() ��
�� ![]() ��������֪��b����4��Pԭ��Χ�ɵ�������������ģ�Pԭ��λ�ڶ��㣬��B-P���ij���Ϊ
��������֪��b����4��Pԭ��Χ�ɵ�������������ģ�Pԭ��λ�ڶ��㣬��B-P���ij���Ϊ![]() ��
��
lΪ�����߳�= ������B-P���ij���Ϊ
������B-P���ij���Ϊ pm��
pm��

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�