题目内容
15.(1)写出下列物质的电子式:①H2O
 ②HCl
②HCl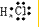 ③Cl2
③Cl2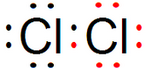 ④CO2
④CO2 ⑤KCl
⑤KCl
(2)用电子式表示下列物质的形成过程:
①MgCl2
 ②Br2
②Br2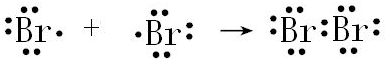 .
.
分析 (1)①水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键;
②氯化氢为共价化合物,分子中含有1个氢氯键;
③氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构;
④二氧化碳分子中含有两个碳氧双键,C、O原子最外层都达到8电子稳定结构;
⑤氯化钾为离子化合物,电子式中需要标出阴阳离子所带电荷;
(2)①镁原子最外层有两个电子易失去最外层的2个电子形成稳定的镁离子,卤原子最外层有7个电子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁;
②溴分子中,两个溴原子通过1对共用电子结合,据此用电子式表示出其形成过程.
解答 解:(1)①水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,
,
故答案为: ;
;
②氯化氢为共价化合物,其分子中含有1个氢氯键,氯化氢的电子式为: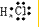 ,
,
故答案为: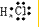 ;
;
③Cl2分子中含有1个共价键,其电子式为: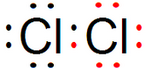 ,
,
故答案为: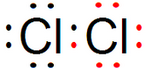 ;
;
④二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,
,
故答案为: ;
;
⑤KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ,
,
故答案为: ;
;
(2)①镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为: ,
,
故答案为: ;
;
②溴分子中含有1个Br-Br共价键,溴的电子式为: ,用电子式表示溴的形成过程为:
,用电子式表示溴的形成过程为: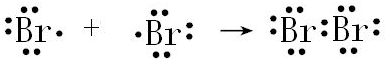 ,
,
故答案为: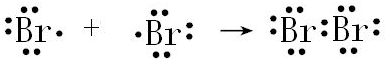 .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别,试题培养了学生规范答题的能力.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
5.下列关于如图物质的命名正确的是( )
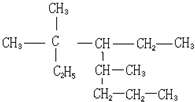

| A. | 2,4-二甲基-2,3-二乙基庚烷 | B. | 2,2,4-三甲基-3-乙基庚烷 | ||
| C. | 3,3,5-三甲基-4-乙基辛烷 | D. | 3,5,5-三甲基-5-乙基辛烷 |
6.一定体积的N2、O2、CO2混合气体通过足量的Na2O2后,同温同压下体积变为原来的0.75倍,原混合气体中N2、O2、CO2物质的量之比可能为( )
| A. | 1:1:2 | B. | 4:3:5 | C. | 1:2:1 | D. | 6:7:14 |
3.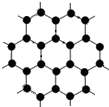 石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )
石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )
 石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )
石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
20.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 在无色溶液中滴入酚酞试液 | 产生气泡 | 该溶液一定是碱溶液 |
| D | 将水蒸气通过灼热的铁粉 | 溶液变红色 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
7.还原2.4molXO(OH)3+到X元素的低价态时,需消耗3mol/L的Na2SO3溶液2L,则在此反应中X元素的低价态为( )
| A. | 0价 | B. | +1价 | C. | -1价 | D. | -2价 |
5.某容积固定的密闭容器内发生反应X(g)+2Y(g)?2Z(g)△H=akJ•mol-1(a>0),若向密闭容器中通入1molX和2molY,达平衡状态时,吸收热量bKJ,则下列判断正确的是( )
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a>b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 密闭容器中X和Y的物质的量之比为1:2时,该反应达到化学平衡状态 |
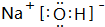
 ,Br -的电子式:
,Br -的电子式: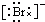 ,CO2的结构式:O=C=O
,CO2的结构式:O=C=O
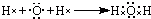 .
.