题目内容
10.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题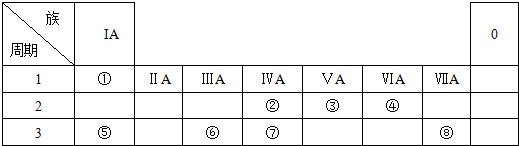
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O(填元素符号)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3 (填化学式)
(3)①、④、⑤中的元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
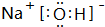
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab
a.MnO2b.Na2SO3 c.KMnO4 d.FeCl3
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
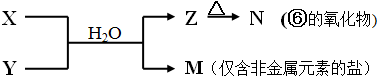
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
Z→N的化学方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
分析 由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)由H、O、Na元素形成既含离子键又含极性共价键的化合物为NaOH,由钠离子与氢氧根离子构成;
(4)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应;
(5)M是仅含非金属的盐,所以M一定是铵盐,Z→N(⑥的氧化物),⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应.
解答 解:由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,故答案为:HNO3>H2CO3>H2SiO3 ;
(3)由H、O、Na元素形成既含离子键又含极性共价键的化合物为NaOH,由钠离子与氢氧根离子构成,电子式为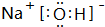 ,故答案为:
,故答案为: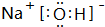 ;
;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(5)M是仅含非金属的盐,所以M一定是铵盐,Z→N(⑥的氧化物),⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,则:
X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
Z→N的化学方程式为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题考查了元素周期表与元素周期律、无机物推断等,难度中等,注意元素周期表与元素周期律的理解掌握.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 124 g P4含有P-P键的个数为4NA | B. | 1mol Na2O2晶体中含离子数为4NA | ||
| C. | 22.4LCH4的分子数为NA | D. | 26g C2H2中π键数目为2NA |
| A. | lmol Cl2参加反应,转移的电子数一定为2NA个 | |
| B. | 18g D2O(重水)完全电解,转移2NA个电子 | |
| C. | 1L lmol•L-1 Na2CO3溶液中CO32-数目为NA | |
| D. | 16g甲烷含有4NA个C-H键 |
| A. | Fe2O3 | B. | FeS | C. | Cu(OH)2 | D. | C |
| A. | 原子序数的大小顺序是:B<A<C<D | |
| B. | 离子半径由大到小的顺序是:B2+>A+>C->D2- | |
| C. | A、B、C、D四种元素原子具有相同的电子层数 | |
| D. | 金属性A>B,非金属性C>D |
①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12.
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①③④⑤⑥ | D. | ①②③④⑤⑥ |
 .
. ②HCl
②HCl ③Cl2
③Cl2 ④CO2
④CO2 ⑤KCl
⑤KCl
 ②Br2
②Br2 .
.