题目内容
(1)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
①实验中观察到的现象是_______________________。
②产生上述现象的原因是_______________________。
③写出有关反应的离子方程式____________。
④由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。

(2)城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭与水蒸气在高温下反应制得,故又称水煤气。试解答:
①写出制取水煤气的主要化学方程式____________。该反应是____________反应(填吸热、放热)。
②设液化石油气的主要成分为丙烷(C3H8),其充分燃烧后产物为CO2和H2O。试比较完全燃烧等质量的C3H8及CO所需的氧气的体积比(同温、同压下)为:____________。
③氢气是未来的能源,燃烧时除产生热量外,还具有的优点是____________。
④使用管道煤气必须防止因煤气泄漏而引起的中毒和爆炸。某住房因煤气泄漏而发生爆炸事故。
调查发现煤气是在达到室内空气质量的6%时发生爆炸的,该住户煤气泄漏速度为0.6g/min,问爆炸时煤气已泄漏约________小时(假设厨房体积为25m3,空气密度约为1.29g/L)。
答案:

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 如图所示,把试管小心地放入盛有25℃饱和澄清石灰水的烧
如图所示,把试管小心地放入盛有25℃饱和澄清石灰水的烧 如图所示,把试管放入盛有25℃澄清饱和石灰水的烧杯中,试管中开始放入几块镁条,再用滴管滴入5mL的盐酸于试管中.试回答下列问题:(提示:Ca(OH)2溶解度随着温度的升高而减小)
如图所示,把试管放入盛有25℃澄清饱和石灰水的烧杯中,试管中开始放入几块镁条,再用滴管滴入5mL的盐酸于试管中.试回答下列问题:(提示:Ca(OH)2溶解度随着温度的升高而减小)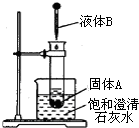 如图所示,把试管放人盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
如图所示,把试管放人盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题: