题目内容
13.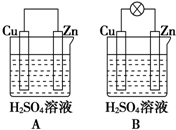 观察图A、B,回答下列问题:
观察图A、B,回答下列问题:(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片没有(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为2H++2e-═H2↑.
(2)如果烧杯中最初装入的是500mL 2mol•L-1的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到(11.2L的氢气时,锌反应掉32.5克,转移电子1mol.
分析 (1)铜不活泼,与硫酸不反应,锌和铜形成原电池时,锌为负极,铜为正极,正极上生成氢气;
(2)当在标准状况下收集到11.2L的氢气时,结合电池总反应计算.
解答 解:(1)铜片插入稀硫酸中时,二者不反应,没有气泡产生,但当把铜片和锌片用导线相连插入稀硫酸中时,会构成原电池,铜作为原电池正极,电极反应为2H++2e-═H2↑,锌作为原电池负极,电极反应为Zn-2e-═Zn2+,电池总反应为Zn+2H+═Zn2++H2↑,故答案为:没有;2H++2e-═H2↑;
(2)当收集到11.2L H2(标准状况),即0.5mol H2时,消耗的Zn为0.5mol,则转移电子1mol,反应掉锌为0.5×65=32.5克
故答案为:32.5;1.
点评 本题考查原电池知识,侧重于学生的基础知识的综合运用和计算能力的考查,注意把握原电池的工作原理以及电极方程式的书写,学习中注意体会,难度不大.

练习册系列答案
相关题目
11.有关物质性质或用途的说法正确的是( )
| A. | 浓硫酸具有强氧化性,故不可用作干燥二氧化硫气体 | |
| B. | 明矾可用作净水剂、晶体硅用来制作光导纤维 | |
| C. | 稀硫酸中加入KNO3可使金属铜溶解 | |
| D. | 氯气通入品红溶液中溶液褪色,说明Cl2具有漂白性 |
4.化学与工农业生产和人类生活密切相关,下列说法中正确的是( )
| A. | 超高分辨荧光显微技术能观察到纳米尺度,故能看见化学键的断裂与形成 | |
| B. | 把粉末状的氢化钛泡沫剂添加到熔融的金属铝中,冷却后可得到强度大、质量轻的金属泡沫,利用该金属泡沫可以建造海上漂浮城市 | |
| C. | 煤液化的途径之一是将煤转化为CO和N2再合成甲醚 | |
| D. | 向汽油中添加乙醇后,该混合燃料的热值不变,但可以达到减排的目的 |
8.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 工业上用石灰对煤燃烧后形成的烟气进行脱硫,并能回收得到石膏 | |
| C. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| D. | 电解MgCl2溶液,可制得金属镁 |
18.化合物丙可由如下反应得到:C4H10O$→_{△}^{浓H_{2}SO_{4}}$C4H8$→_{溶剂CCl_{4}}^{Br_{2}}$C4H6Br2.丙的结构简式不可能是( )
| A. | CH3CH(CH2Br)2 | B. | (CH3)2C Br CH2 Br | ||
| C. | C2H5CH Br CH2 Br | D. | CH3(CH Br)2CH3 |
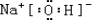 ;w属于非极性 (填“极性”或“非极性)分子;
;w属于非极性 (填“极性”或“非极性)分子;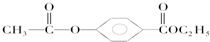 .A经①②两步反应得到C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如图所示.
.A经①②两步反应得到C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如图所示.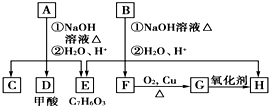
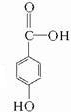 .
.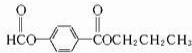 和
和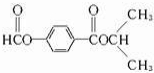 .
.