题目内容
(16分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:
合成塔中反应的化学方程式为 ;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考 虑温度对反应速率的影响外,还主要考虑了 。
虑温度对反应速率的影响外,还主要考虑了 。
从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)。
| A.过滤 | B.分液 | C.蒸馏 | D.结晶 |
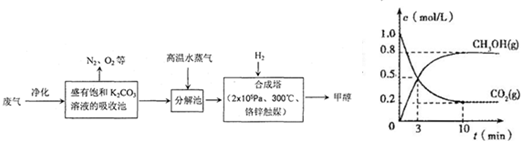
(4)在体积为2L的合成塔中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2) =______________;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有 。

(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知CH4(g)+2O2(g)=" CO2(g)+2H2O(l)" ΔH1=-890.3kJ/mol
H2 (g)+ O2(g)=" H2O(l)" ΔH2=-285.8kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________________。
(16分)
(1)CO2+3H2→ CH3OH+H2O (3分); 催化剂的催化活性(2 分)
(2)C(2分)
(3)高温水蒸气(2分)
(4)0.24mol/(L·min)(2分);增大H2的用量等(2分)
(5)CO2(g)+4H2 (g) =" CH4(g)+2H2O(l)" ΔH=-252.9kJ/mol(3分)
解析

练习册系列答案
相关题目