题目内容
【题目】Ⅰ.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____mol·L-1·s-1。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A 压强不再变化 B υ(A)正=2υ(B)逆
C 气体密度不再变化 D A的百分含量保持不变
E A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+ 3Ag2O + 2KOH = 6Ag + 2KAlO2 + H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”)其电极反应式为______。
(2)电子由_____极经外电路流向___极(填“Ag2O”或“Al”),当有 1mol电子流经外电路时,负极质量减少___g。
(3)溶液中的 OH-向____极迁移(填“Ag2O”或“Al”)。
【答案】0.01 3 BCD 正 Ag2O+2e-+H2O=2Ag+2OH- Al Ag2O 9 Al
【解析】
(1)2min达到平衡,C的浓度为1.2mol/L,结合![]() 计算;
计算;
(2)2min时反应达到平衡状态,此时剩余1.2mol B,计算B的反应速率,反应速率之比等于化学计量数之比;
(3)反应达到平衡状态正逆反应速率相等,各组分含量保持不变,据此分析作答;
Ⅱ. 该原电池中,Al元素化合价由0价变为+3价而发生氧化反应,所以为负极,则Ag2O为正极;失电子的物质发生氧化反应,被氧化;放电时,电子从负极沿导线流向正极;电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析作答。
(1)2min达到平衡,C的浓度为1.2mol/L,由![]() =
=![]() =0.6mol/(L·min),υ(C)=
=0.6mol/(L·min),υ(C)=![]() mol/(L·s)=0.01mol/(L·s);
mol/(L·s)=0.01mol/(L·s);
(2)2min时反应达到平衡状态,此时剩余1.2mol B,则B的反应速率为![]() =0.2mol/(L·min),由反应速率之比等于化学计量数之比可知,x=3,故答案为:3;
=0.2mol/(L·min),由反应速率之比等于化学计量数之比可知,x=3,故答案为:3;
(3)2A(g)+B(g)3C(g)+2D(s),反应前后气体体积不变,则
A. 反应前后气体体积不变,反应过程中和平衡状态下压强始终不变化,压强不变不能说明反应达到平衡状态,A项错误;
B. 反应速率之比等于化学方程式系数之比,υ(A)正=2υ(B)逆,说明正逆反应速率相等,反应达到平衡状态,B项正确;
C. 反应前后气体质量变化,气体体积不变,气体密度不再变化,说明反应达到平衡状态,C项正确;
D. A的百分含量保持不变,则说明反应达到平衡状态,D项正确;
E. A的消耗速率与C的消耗速率之比为2:1,根据化学计量数易知,不能说明正逆反应速率相等,即不能表明反应达到平衡状态,E项错误;
故答案为:BCD;
Ⅱ. 该原电池中,Al元素化合价由0价变为+3价而发生氧化反应,所以为负极,则Ag2O为正极;,
(1)根据原电池工作原理,化合价升高,失电子的作负极,即铝单质作负极,则Ag2O作电池的正极,其电极反应式为:Ag2O+2e-+H2O=2Ag+2OH-;
(2)电子由Al极经外电路流向Ag2O极;负极电极反应式为:Al-3e- +4OH-=AlO2-+2H2O,当有1mol电子流经外电路时,负极质量减少![]() =9g;
=9g;
(3)放电过程中,溶液中的阴离子向负极移动,则溶液中的OH-向Al极移动,故答案为:Al。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
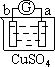
小学生10分钟应用题系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c