题目内容
【题目】兴趣小组同学用下图所示的装置来制备溴苯并探究其反应类型。
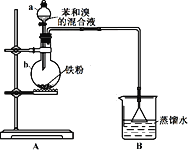
(1)仪器a名称为_________。B装置的作用是__________________。
(2)打开a的活塞将苯和溴的混合液滴入b中,反应立即开始。写出b中发生有机反应的化学方程式______________________。
(3)实验开始后,首先观察到b中液体沸腾,且装置内充满红棕色气体。然后观察到B中倒扣的漏斗内现象是__________________,说明b中反应有HBr生成,证明制备溴苯的反应是取代反应。
(4)甲同学向B装置的烧杯中滴入几滴AgNO3溶液,观察到_________________,据此进一步确证有HBr生成。乙同学认为甲同学的判断并不准确,则可能的理由是___________。如果要排除干扰,可在A、B之间增加一个洗气瓶,内装试剂可以是__________________(选填序号)。
①NaOH溶液 ②饱和Na2CO3溶液 ③Na2SO3溶液 ④CCl4
(5)纯硝基苯是无色、难溶于水,密度比水大,具有苦杏仁味的油状液体。实验室制备硝基苯的装置如图所示,主要步骤如下(并非正确顺序):
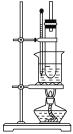
a.配制一定比例的浓硫酸与浓硝酸混合酸,加入反应器中。
b.在50~60 ℃下发生反应,直至反应结束。
c.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
d.向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
e.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
回答下列问题:
①步骤b中的加热方法为__________,其优点是_________________________________________。
②粗产品用5%NaOH溶液洗涤的目的是_____________。
【答案】分液漏斗 吸收HBr,防止液体倒吸 ![]() +Br2
+Br2![]()
![]() +HBr 出现白雾,液面上升 烧杯中产生浅黄色沉淀 Br2蒸气进入AgNO3溶液也会产生浅黄色沉淀 ④ 水浴加热 受热均匀,易控制温度 除去粗产品中残留的酸
+HBr 出现白雾,液面上升 烧杯中产生浅黄色沉淀 Br2蒸气进入AgNO3溶液也会产生浅黄色沉淀 ④ 水浴加热 受热均匀,易控制温度 除去粗产品中残留的酸
【解析】
(1) B装置的作用是吸收HBr,防止液体倒吸;
(2)苯和溴在溴化铁作催化剂条件下生成溴苯和溴化氢;
(3)反应产生的HBr极易溶于水,气压减小,且会与水蒸气结合成小液滴,有白雾;
(4) AgNO3溶液与HBr和Br2蒸气均会产生溴化银沉淀。如果要排除干扰,可在A、B之间增加一个洗气瓶,除去HBr中的Br2蒸气;
(5) ①50~60 ℃采用水浴加热,优点是受热均匀,易控制温度;
②5%NaOH溶液洗涤的目的是除去粗产品中残留的酸。
(1)仪器a名称为分液漏斗。反应产生的HBr经长导管进入B装置,B装置倒置的漏斗具有较大的空间可防止倒吸,故B装置的作用是吸收HBr,防止液体倒吸;
(2)苯和溴在溴化铁作催化剂条件下生成溴苯和溴化氢,发生的有机反应的化学方程式为![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(3) 反应产生的HBr极易溶于水,会与水蒸气结合成小液滴,故倒扣的漏斗内现象是出现白雾,液面上升。
(4) B装置的烧杯中有AgNO3溶液,会产生溴化银沉淀,故观察到烧杯中产生浅黄色沉淀。溴易挥发,Br2蒸气进入AgNO3溶液也会产生浅黄色沉淀,不能确证有HBr生成。如果要排除干扰,可在A、B之间增加一个洗气瓶,除去HBr中的Br2蒸气,
①NaOH溶液会与HBr反应,故①错误;
②饱和Na2CO3溶液会与HBr反应,故②错误;
③Na2SO3溶液会与HBr反应,故③错误;
④CCl4不会与HBr反应,且能吸收Br2蒸气,故④正确;
答案选④;
(5) ①在50~60 ℃下发生反应,故步骤b中的加热方法为水浴加热,其优点是受热均匀,易控制温度;
②除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,先用蒸馏水除去部分酸,粗产品用5%NaOH溶液洗涤的目的是除去粗产品中残留的酸。






