题目内容
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,
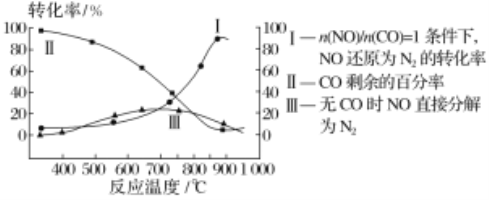
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为_________________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在____________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:_________。
③NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2-的水解常数K=2×10-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为__________。
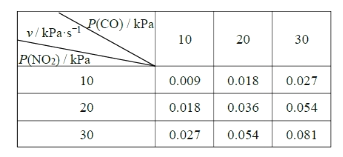
II.T ℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn(NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
(3)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
【答案】-750 kJ·mol-1 降温、升压、增大CO和NO的投料比等 该反应是放热反应,升高温度反应更有利于向逆反应方向进行 870℃(850℃到900℃之间都可以) 4C2H6+14NO2 ![]() 8CO2+7N2+12H2O 50 9×10-5(a-b)2
8CO2+7N2+12H2O 50 9×10-5(a-b)2 ![]()
【解析】
I.(1)根据盖斯定律计算;从使化学反应平衡向正向移动的影响因素着手考虑;
(2)①升高温度反应更有利于向逆反应方向进行;结合图像找出在n(NO)/n(CO)=1的条件下转化率最高对应的温度作答;
②NO2能与乙烷发生氧化还原反应,转化为无污染的二氧化碳与氮气,再结合氧化还原反应的规律配平化学方程式;
③根据NO2-的水解常数K=c(HNO2)×c(OH-)/c(NO2-)分析作答;
(3)根据平衡三段式法,结合题中信息根据平衡常数的定义与化学反应速率的定义计算作答。
I.(1)根据盖斯定律①×2-[③×2-②]可得2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=-750 kJ·mol-1;该反应的正反应为气体体积减小的放热反应,故降温和升压都可以使平衡右移,有利于提高NO 的平衡转化率,
故答案为:-750 kJ·mol-1;降温、升压;
(2)①应用反应是放热反应,升高温度反应更有利于向逆反应方向进行,所以NO的分
解率降低。根据图像可知,在n(NO)/n(CO)=1的条件下,温度为870℃(850℃到900℃之间都可以)转化率最高,
故答案为:该反应是放热反应,升高温度反应更有利于向逆反应方向进行;870℃(850℃到900℃之间都可以);。
②NO2能与乙烷反应生成CO2、氮气和水,其方程式为:4C2H6+14NO2 ![]() 8CO2+7N2+12H2O,
8CO2+7N2+12H2O,
故答案为:4C2H6+14NO2 ![]() 8CO2+7N2+12H2O;
8CO2+7N2+12H2O;
③常温下某NaNO2和 HNO2 混合溶液的pH为5,则溶液中c(OH-)=10-9 mol·L-1,NO2-的水解常数K=c(HNO2)×c(OH-)/c(NO2-)=2×10-11mol·L-1,则混合溶液中c(NO2-)和c(HNO2)的比值为c(NO2-)/c(HNO2)=c(OH-)/2×10-11 mol/L= 10-9 mol·L-1/2×10-11 mol/L = 50,
故答案为:50;
II.(3)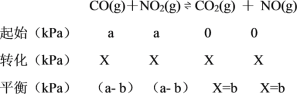
则Kp=![]() ,根据表格中数据,带入此式,v =k Pm(CO)Pn( NO2),可求出k= v / Pm(CO)Pn( NO2) =0.009/(10×10)=9×10-5,所以t min时v =9×10-5(a-b)2,
,根据表格中数据,带入此式,v =k Pm(CO)Pn( NO2),可求出k= v / Pm(CO)Pn( NO2) =0.009/(10×10)=9×10-5,所以t min时v =9×10-5(a-b)2,
故答案为:9×10-5(a-b)2;![]() 。
。

 阶梯计算系列答案
阶梯计算系列答案