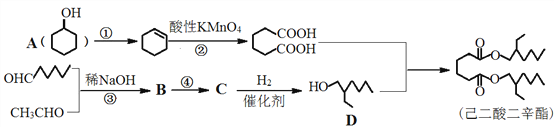
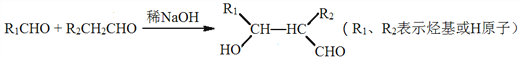
题目内容
【题目】我国城市为了减少燃煤造成的大气污染,对作民用燃料的煤作了多方面的改进。
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反应:FeS2+14FeCl3+8H2O===2FeSO4+13FeCl2+16HCl。
①该反应中的氧化剂是________,若有1 mol FeS2被除去,则发生转移的电子的物质的量是________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和氯气让废液重新利用生成FeCl3。请写出这一过程中有关的离子方程式_____________________________、_________________________。
(2)某城市采用了以油制气代替煤作民用燃料的做法。油制气的主要成分是丙烷,请写出其燃烧的化学方程式:_______________________________。
(3)绿色能源是人类的理想能源,不会造成环境污染,下列能源属于绿色能源的是________。
A.氢能源 B.太阳能 C.风能 D.石油
【答案】FeCl314 molFe+2H+===Fe2++H2↑2Fe2++Cl2===2Fe3++2Cl-C3H8+5O2![]() 3CO2+4H2OABC
3CO2+4H2OABC
【解析】
(1) ①反应中FeS2中S由-1价升高至+6价,每1 mol FeS2被氧化,转移14 mol电子,FeCl3中Fe由+3价降至+2价,FeCl3作氧化剂;②加入废铁屑是消耗H+,减少污染,而通入Cl2是氧化Fe2+,有关的离子方程式为Fe+2H+===Fe2++H2↑、2Fe2++Cl2===2Fe3++2Cl-;(2)C3H8燃烧的化学方程式为C3H8+5O2![]() 3CO2+4H2O;(3)氢能源、太阳能、风能均属于绿色能源。答案选ABC。
3CO2+4H2O;(3)氢能源、太阳能、风能均属于绿色能源。答案选ABC。

 阅读快车系列答案
阅读快车系列答案【题目】能源是人类生存与发展必不可缺的物质,对传统能源进行脱硫、脱硝处理,能提高能源在能源消费中的比例是改变目前我国频发的雾霾天气的有效措施。
(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有10e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式__________________。
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g) △H=十8.0 kJ·mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g) △H=+90.4 kJ·mol-1
③2CO(g)+O2 (g) =2CO2 (g) △H= -566.0 kJ·mol-1
④2H2 (g)+O2 (g) =2H2O(g) △H =-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式为__________________。
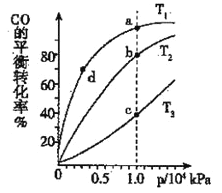
(3)煤炭液化也有助于减少雾霾天气的发生,液化反应之一为:CO(g)+2H2(g)![]() CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。
CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:2CO(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
容器 | c(CO) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)与v(逆)大小比较 |
I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)= v(逆) |
II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v(正)____v(逆)(填“>” |
填写表中空白处,并写出其推测过程___________。
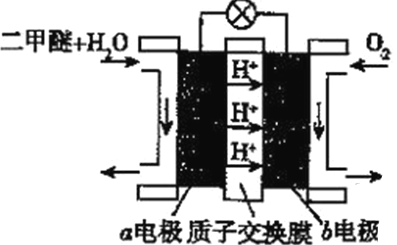
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图所示,a、b均为惰性电极,a极的电极反应式为________________________;当消耗1molO2时,通过质子交换膜的质子数为_________NA;若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为________(燃烧电池的工作效率是指电池所能产生的最大电能与燃料燃烧时所能释放的全部热能之比)。