题目内容
向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol·L -1HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(1)Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物
质的量为 。
(1)3Cu2O+ 14H+ + 2NO3-=6Cu2+ +2 NO↑+ 7H2O (2)16 (3)0.1mol
解析试题分析:(1)Cu2O跟稀硝酸反应的离子方程式为3Cu2O+ 14H+ + 2NO3-=6Cu2+ +2 NO↑+ 7H2O。(2)n(HNO3)=0.6mol,n(NO)=2.24L÷22.4L/mol=0.1mol.所以n(Cu(NO3)2)=1/2n(NO3-)=0.25mol.所以若将上述混合物用足量的H2加热还原,所得到固体的质量即为Cu的质量。m(Cu)= 0.25mol×64g/mol=16g。(3)若混合物中含0.1 mol Cu,根据方程式3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O可知Cu产生的NO的物质的量为0.2/3mol,则Cu2O与硝酸反应产生的NO的物质的量为0.1mol-2/3×0.1mol=0.1/3mol.在根据3Cu2O+ 14H+ + 2NO3-=6Cu2+ +2 NO↑+ 7H2O可计算出Cu2O的物质的量为0.05mol.所以CuO物质的量为(0.15-0.2/3-0.1/3)mol=0.05mol结合方程式:CuO+H2SO4=CuSO4+H2O; Cu2O+H2SO4="Cu+" Cu SO4+H2O.可知:消耗的H2SO4的物质的量为0.05mol+0.05mol=0.1mol.
考点:考查Cu、Cu2O和CuO与硝酸、硫酸反应原理及离子方程式的书写及个组分含量的计算。

二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
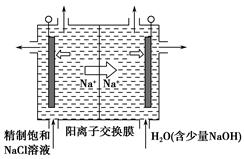
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:____________________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________;处理100 m3这种污水,至少需要ClO2________mol。
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 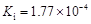 |  | 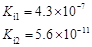 | 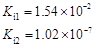 |
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2 → 2HClO + CO32-
B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,
 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:HI+ H6TeO6
 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O(6)若反应中生成的TeO2与Te的物质的量之比为
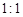 ,试配平上述化学方程式。
,试配平上述化学方程式。 
 2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0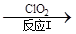 NO2
NO2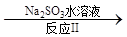 N2
N2
 ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O Cu(NO3)2
Cu(NO3)2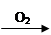 CuO
CuO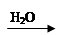 Cu(OH)2
Cu(OH)2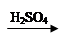 CuSO4
CuSO4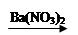 Cu(NO3)2
Cu(NO3)2