题目内容
15. 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义(1)氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
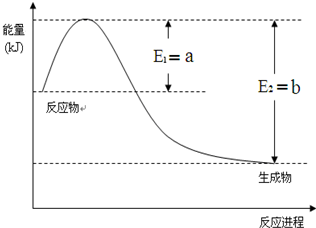
①如图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ•mol-1.(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25°C下,将m mol•L-1的氨水与n mol•L-1的盐酸等体积混合,反应后的溶液呈中性,则c(NH+4)=c(Cl-)(填“>”、“<”或“=”);用含m和n的代数式表示出混合液中氨水的电离平衡常数表达式K=$\frac{n×1{0}^{-7}}{m-n}$.
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.25°C下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是Qc>Ksp,向反应后的浊液中,继续加入适量0.1mol•L-1的NaI溶液,振荡、静置,看到的现象是白色沉淀转化为黄色沉淀,产生该现象的原因是(用离子方程式表示)AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
(已知25°C时Ksp[AgCl]=1.0×10-10mol2•L-2,Ksp[Ag]=1.5×10-16mol2•L-2)
分析 (1)①由图求出N2和H2反应生成1molNH3的反应热,再根据热化学反应方程式的书写解答;
②根据电荷守恒,判断离子浓度大小;氨水的电离平衡常数为电离出离子的浓度积与溶质浓度的比值;
(2)当浓度积Qc>Ksp时,会生成沉淀;向AgCl浊液中加入NaI溶液,发生沉淀的转化:AgCl(s)+I-(aq)=AgI(s)+Cl-(aq);
解答 解:(1)①由图可知,N2和H2反应生成1molNH3放出的热量为(b-a)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ•mol-1;
②将m mol•L-1的氨水与n mol•L-1的盐酸等体积混合,反应后的溶液呈中性,则氨水必须稍微过量,根据溶液的电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液呈中性,即c(H+)=c(OH-)=10-7mol/L,即c(NH4+)=c(Cl-)=$\frac{n}{2}$mol/L.溶液中氨水过量,过量的氨水的浓度c(NH3•H2O)=$\frac{m-n}{2}$mol/L,氨水中的电离常数为$\frac{c(N{{H}_{4}}^{+})•c({H}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{\frac{n}{2}×1{0}^{-7}}{\frac{m-n}{2}}$=$\frac{n×1{0}^{-7}}{m-n}$,故答案为:=;=$\frac{n×1{0}^{-7}}{m-n}$;
(2)25°C下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,当浓度积Qc>Ksp时,会生成沉淀;
向AgCl浊液中加入NaI溶液,溶度积常数可知碘化银溶解度小于氯化银,发生沉淀的转化,白色沉淀转化为黄色沉淀:反应的离子方程式为:AgCl(s)+I-(aq)=AgI(s)+Cl-(aq);
故答案为:Qc>Ksp;白色沉淀转化为黄色沉淀,AgCl(s)+I-(aq)=AgI(s)+Cl-(aq);
点评 本题考查了热化学方程式书写、电离平衡常数的有关计算和沉淀转化理解应用,题目难度中等.

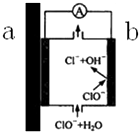 自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )| A. | 如果是镀锌管,则a端为Zn,是负极,产生Zn2+,不但会造成管道锈蚀,Zn2+溶于自来水也对人体有害 | |
| B. | b端发生的电极反应为:ClO-+H2O-2e-═Cl-+2OH- | |
| C. | 由于该原电池原理的存在,一定程度上减弱了自来水中余氯的杀菌消毒功能 | |
| D. | 从自来水厂到用户,经过该类管道的长期接触,自来水的酸碱性发生了变化 |
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 物质的量浓度相等的CH3COONa、NaOH和Na2CO3三种溶液:pH(NaOH)>pH(CH3COONa)>pH(Na2CO3) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中c(OH-)相等 |
| A. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g | |
| C. | 在反应3Cl2+8NH3═6NH4Cl+N2中,有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g | |
| D. | 等物质的量的CH4和CO所含分子数均为NA |
①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,
有关上述溶液的说法,正确的是( )
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 | |
| D. | 分别向等体积的上述溶液中加入100 mL,水,溶液的pH:③>④>①>② |
①熔沸点较高 ②能溶于水 ③水溶液能导电 ④有较深的颜色 ⑤熔融状态不导电.
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
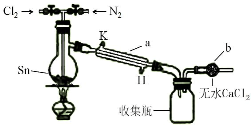 四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.
四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.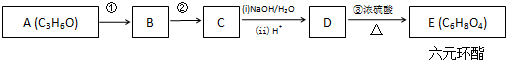
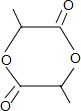 +2H2O.
+2H2O. 已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空:
已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空: