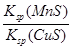��Ŀ����
�Ӻ�ˮ����ȡþ������������þ����Ҫ��Դ����������ȡþ�Ĺ������漰�ļ������ʵ��ܶȻ�����������ѧ��֪ʶ�ش����м������⣺
(1)�ڴӺ�ˮ����ȡþʱ�������õ�����(��Ҫ�ɷ���̼���)������Ϊ (��ܡ����ܡ�)��������ĥ�ɷ�ĩֱ��Ͷ�뺣ˮ�У������� ���������ֱ��Ͷ�룬Ӧ���������δ�������д����ѧ����ʽ ��
(2)ijͬѧ��ʵ����������ģ����������̣���ʵ������ʯ�ң����������ռ���棬����Ϊ (����ԡ������ԡ�)�õ�Mg(OH)2���ڼ��Լ�ʱ��������Һ���뺣ˮ�У���˼����һ�£����ڵõ��Ļ����ϵ�м���������ռ���Һ��������� (��ܡ����ܡ�)��Mg2+ת��ΪMg(OH)2������������ (�����ӷ���ʽ��ʾ)��
(3)��֪��ˮ��þ����Ũ��Ϊ1.8��10�C3mol��L�C1����Ҫʹþ���Ӳ�����������Һ��PH���ӦΪ ��
| ���� | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| �ܶȻ� | 2.8��10�C9 | 6.8��10�C6 | 5.5��10�C6 | 1.8��10�C11 |
(1)�ڴӺ�ˮ����ȡþʱ�������õ�����(��Ҫ�ɷ���̼���)������Ϊ (��ܡ����ܡ�)��������ĥ�ɷ�ĩֱ��Ͷ�뺣ˮ�У������� ���������ֱ��Ͷ�룬Ӧ���������δ�������д����ѧ����ʽ ��
(2)ijͬѧ��ʵ����������ģ����������̣���ʵ������ʯ�ң����������ռ���棬����Ϊ (����ԡ������ԡ�)�õ�Mg(OH)2���ڼ��Լ�ʱ��������Һ���뺣ˮ�У���˼����һ�£����ڵõ��Ļ����ϵ�м���������ռ���Һ��������� (��ܡ����ܡ�)��Mg2+ת��ΪMg(OH)2������������ (�����ӷ���ʽ��ʾ)��
(3)��֪��ˮ��þ����Ũ��Ϊ1.8��10�C3mol��L�C1����Ҫʹþ���Ӳ�����������Һ��PH���ӦΪ ��
(1)����(1��)�� ������ĥ�ɷ�ĩ����CaCO3��CaCO3���ܽ�ȱ�MgCO3���ܽ��С�����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3(2��)�� CaCO3 CaO + CO2��(2��)�� (2)����(1��)��
CaO + CO2��(2��)�� (2)����(1��)��
��(1��)�� CO32�C + Mg2+ = MgCO3��MgCO3 + 2OH�C = Mg(OH)2 + CO32�C(4��) (3)10(2��)
 CaO + CO2��(2��)�� (2)����(1��)��
CaO + CO2��(2��)�� (2)����(1��)����(1��)�� CO32�C + Mg2+ = MgCO3��MgCO3 + 2OH�C = Mg(OH)2 + CO32�C(4��) (3)10(2��)
���������(1)������ĥ�ɷ�ĩ����CaCO3��CaCO3���ܶȻ���MgCO3���ܶȻ�С�����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3��Ӧ���������ճ�CaO��CaOͶ�뺣ˮ�����ɵ�Ca(OH)2ʹ��ˮ�е�Mg2+ת��ΪMg(OH)2������(2)NaOH�������OH�C����Mg2+��Ӧ����Mg(OH)2������Mg(OH)2���ܶȻ�MgCO3���ܶȻ�������ͨ�����ռӦ��MgCO3����ת��ΪMg(OH)2������MgCO3 + 2OH�C = Mg(OH)2 + CO32�C��(3)Ksp[Mg(OH)2]=c(Mg2+)��c2(OH�C)=1.8��10�C3��c2(OH�C)=1.8��10�C11�������c(OH�C)=1��10�C4����pH=10��

��ϰ��ϵ�д�
�����Ŀ
 mMn+��aq�� + nAm����aq����Ksp��[c��Mn+��]m��[c��Am����]n��
mMn+��aq�� + nAm����aq����Ksp��[c��Mn+��]m��[c��Am����]n��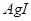 �����е���ŨKCI��Һ�а�ɫ��������
�����е���ŨKCI��Һ�а�ɫ��������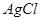 ��
��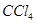 �����ã��²���ҺΪ��ɫ
�����ã��²���ҺΪ��ɫ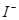
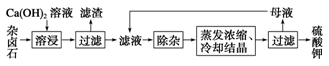
 2Ca2����2K����Mg2����4SO42-��2H2O��Ϊ�ܳ�����ü���Դ���ñ���Ca(OH)2��Һ�ܽ���±ʯ�Ʊ�����أ������������£�
2Ca2����2K����Mg2����4SO42-��2H2O��Ϊ�ܳ�����ü���Դ���ñ���Ca(OH)2��Һ�ܽ���±ʯ�Ʊ�����أ������������£�