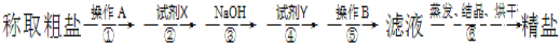题目内容
【题目】Ⅰ.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)2ClNO(g) 平衡常数为K1;
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) 平衡常数为K2。
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
(2)若反应①在温度T下达到平衡时,平衡常数为K1,升高温度后K1增大,则正反应的焓变△H____0(填“>”、“<”或“=”)。若平衡后在其他条件不变的情况下,充入少量Cl2,Cl2的转化率___________(填“变大”、“变小”或“不变”,下同),![]() 的值___________。
的值___________。
Ⅱ.近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g)![]() CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。
CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。

A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
【答案】![]() > 变小 变小 ACD
> 变小 变小 ACD
【解析】
Ⅰ.(1)已知:①2NO(g)+Cl2(g)2ClNO(g) 平衡常数为K1;②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) 平衡常数为K2,则2![]() ②-①既得4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)所以K=
②-①既得4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)所以K=![]() ;(2)因为升高温度K1增大,所以正反应为吸热反应,故△H>0;其他条件不变的情况下,充入少量Cl2,Cl2的转化率变小;由于2NO(g)+Cl2(g)2ClNO(g)增加Cl2的量,虽然平衡向正向移动,但C(Cl2)增加的更大,所以
;(2)因为升高温度K1增大,所以正反应为吸热反应,故△H>0;其他条件不变的情况下,充入少量Cl2,Cl2的转化率变小;由于2NO(g)+Cl2(g)2ClNO(g)增加Cl2的量,虽然平衡向正向移动,但C(Cl2)增加的更大,所以![]() 变小;Ⅱ. A.反应温度超过300℃时,乙酸乙酯的质量分数开始降低,乙醚的质量分数开始升高,所以A合理;B.对于液体物质来说压强对平衡影响较小,所以增大体系压强,对乙醇平有衡转化率影响不大,所以B不合理;C.因为液态收集物中乙醛初期很大,但是慢慢随着乙酸乙酯的增大而减少,所以乙醛应该为中间产物,,所以C合理;D.催化剂有选择性,如果选择优质催化剂,可以减少副反应发生,所以D合理,故本题答案为:ACD。
变小;Ⅱ. A.反应温度超过300℃时,乙酸乙酯的质量分数开始降低,乙醚的质量分数开始升高,所以A合理;B.对于液体物质来说压强对平衡影响较小,所以增大体系压强,对乙醇平有衡转化率影响不大,所以B不合理;C.因为液态收集物中乙醛初期很大,但是慢慢随着乙酸乙酯的增大而减少,所以乙醛应该为中间产物,,所以C合理;D.催化剂有选择性,如果选择优质催化剂,可以减少副反应发生,所以D合理,故本题答案为:ACD。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案